
| A. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| B. | pH=12的溶液中:K+、NO3-、I-、Na+、AlO2- | |
| C. | Na2S溶液中:K+、SO42-、Cl-、Cu2+ | |
| D. | 由水电离的c(H+)=1.0×10-13 mol/L的溶液中:C6H5O-、K+、SO42-、C1- |
分析 A.饱和氯水中不能存在还原性离子;
B.pH=12的溶液,显碱性;
C.离子之间结合生成沉淀;
D.由水电离的c(H+)=1.0×10-13 mol/L的溶液,为酸或碱溶液.
解答 解:A.饱和氯水中不能存在SO32-,发生氧化还原反应不能共存,故A不选;
B.pH=12的溶液,显碱性,该组离子之间不反应,可大量共存,故B选;
C.S2-、Cu2+结合生成沉淀,不能共存,故C不选;
D.由水电离的c(H+)=1.0×10-13 mol/L的溶液,为酸或碱溶液,酸溶液中不能大量存在C6H5O-,故D不选;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


科目:高中化学 来源: 题型:解答题
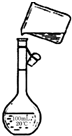 实验室欲配置500mL 0.40mol/L NaNO3溶液.
实验室欲配置500mL 0.40mol/L NaNO3溶液.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
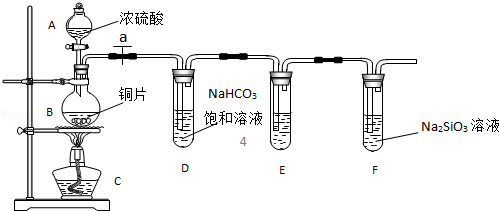
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在潮湿疏松的碱性土壤中 | B. | 在干燥致密的酸性土壤中 | ||
| C. | 将输油管道与电源负极相连 | D. | 在输油管道接口处包上铜皮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g N2O含有的氮原子数目为NA | |
| B. | 常温常压下,22.4L N2含有的分子数目为NA | |
| C. | lmol Mg变为Mg2+时失去的电子数目为2NA | |
| D. | 由CO2和O2组成的混合气体中共有NA个分子,其中的氧分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
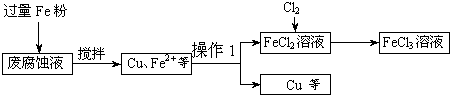

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com