
可逆反应mA(g)+nB pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是( )。
pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是( )。
A.若增加B的量,平衡体系颜色加深,说明B必是气体
B.增大压强,平衡不移动,说明m+n一定等于p+q
C.升高温度,A的转化率减小,说明正反应是吸热反应
D.若B是气体,增大A的量,A、B的转化率都增大
 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:单选题
可逆反应aA(g) + bB(g)  cC(g) + dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是
cC(g) + dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是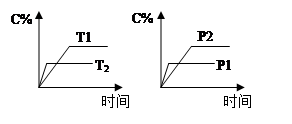
| A.达平衡后,若升温,平衡左移 |
| B.达平衡后,加入催化剂则C%增大 |
| C.化学方程式中a+b>c+d |
| D.达平衡后,减少A的量有利于平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法或解释不正确的是
A.等物质的量浓度的下列溶液中,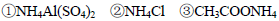
 由大到小的顺序是
由大到小的顺序是
B.室温下,向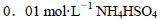 溶液中滴加NaOH溶液至中性:
溶液中滴加NaOH溶液至中性: 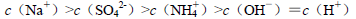

在任何温度下都能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,在密闭容器中进行如下反应: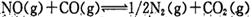
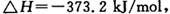 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
| A.加催化剂同时升高温度 |
| B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 |
| D.增大压强同时充入NO |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
相同温度下,体积均为0. 25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
| 容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时体 系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15 kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
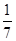
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在常温下,X2(g)和H2反应生成HX的平衡常数如表中所示,仅依据K的变化,关于等物质的量浓度的H2与X2的反应,下列说法正确的是( )
| 化学方程式 | 平衡常数K |
F2+H2 2HF 2HF | 6.5×1095 |
Cl2+H2 2HCl 2HCl | 2.6×1033 |
Br2+H2 2HBr 2HBr | 1.9×1019 |
I2+H2 2HI 2HI | 8.7×102 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一密闭容器中发生反应:2X(g)+Y(g) aZ(g) ΔH=Q kJ·mol-1,开始按体积比2∶1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图象,下列有关说法正确的是( )
aZ(g) ΔH=Q kJ·mol-1,开始按体积比2∶1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图象,下列有关说法正确的是( )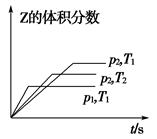
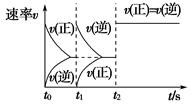
甲 乙
| A.图甲,p1>p2,a<3 |
| B.图甲,T1<T2,Q>0 |
| C.图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体 |
| D.图乙,如果a=3,t2时表示向体系中加入了催化剂或增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一。反应:2NO(g)+2CO(g) 2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
| A.提高尾气净化效率的最佳途径是研制高效催化剂 |
| B.提高尾气净化效率的常用方法是升高温度 |
| C.装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| D.570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
设反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH="a" kJ/mol,反应②Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH="a" kJ/mol,反应②Fe(s)+H2O(g) FeO(s)+H2(g) ΔH="b" kJ/mol,以上两反应的平衡常数分别为K1和K2。在不同温度下,K1、K2的值如下:
FeO(s)+H2(g) ΔH="b" kJ/mol,以上两反应的平衡常数分别为K1和K2。在不同温度下,K1、K2的值如下: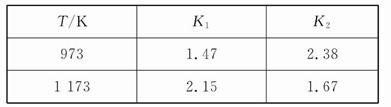
下列有关叙述正确的是( )
| A.b>0 | B.在973K下增大压强,K2增大 |
| C.a>b | D.在常温下反应①一定能自发进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com