
| A. |  | B. |  | C. |  | D. | 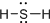 |
分析 A、硫化氢分子的结构与水分子类似,为 V型结构;
B、用最外层电子表示出来的式子为电子式;
C、硫化氢分子的结构与水分子类似,为V型结构;
D、H2S分子中有2对共用电子对,据此分析H2S分子的结构式.
解答 解:A、硫化氢分子中存在两个S-H键,为V型结构,所以H2S分子的比例模型为: ,故A正确;
,故A正确;
B、H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键,电子式为: ,故B错误;
,故B错误;
C、硫化氢分子的结构与水分子类似,为V型结构,而图示的球棍模型中为直线结构,故C错误;
D、H2S分子中有2对共用电子对,则H2S结构式H-S-H,故D错误.
故选A.
点评 本题考查了球棍模型、比例模型和结构式的书写,题目比较简单,熟悉原子电子式、结构式的书写方法是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

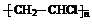 ,GHOOC(CH2)4COOH.
,GHOOC(CH2)4COOH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 按系统命名法命名,图1化合物的名称是2,4,6一三甲基-5-乙基庚烷 | |
| B. | 图2有机物的一种芳香族同分异构体能发生银镜反应 | |
| C. | 图2有机物能使酸性高锰酸钾溶液褪色 | |
| D. | 图3为髙分子化合物,其单体为对苯二甲酸和乙二醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
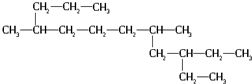 ,用系统命名法命名,该烃的名称为( )
,用系统命名法命名,该烃的名称为( )| A. | 4,8-二甲基-10-乙基12烷 | B. | 5,9-二甲基-3-乙基十二烷 | ||
| C. | 5-甲基-3-乙基-9-丙基十一烷 | D. | 3,9-二甲基-4-乙基十二烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的结构式H-Cl-O | |
| B. | 氯化钠的分子式:NaCl | |
| C. | F-的最外层电子排布式:2s22p5 | |
| D. | D216O中,质量数之和是质子数之和的两倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
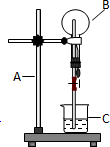 如图为氯化氢气体的喷泉实验装置.烧杯中的液体是紫色石蕊试液
如图为氯化氢气体的喷泉实验装置.烧杯中的液体是紫色石蕊试液查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol氧气的体积约为22.4L | |
| B. | 标准状况下,1mol水的体积约为22.4L | |
| C. | 1mol任何气体,只有在标准状况下体积才约为22.4L | |
| D. | 同温同压下,相同体积的两种气体的物质的量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com