
����Ŀ����A��BΪԭ���Ʊ����߷��ӻ�����M�Ϳ���ѪҩN��һ��·�����£����ַ�Ӧ�������Լ���ȥ����

��֪��I. ��A���ܶ�����ͬ������H2�ܶȵ�14����
I.![]()
II. ![]()
��ش��������⣺
��1��B�Ļ�ѧ����Ϊ____��F�Ľṹ��ʽΪ______��
��2��N�к��������ŵ�����Ϊ _______��
��3��D��E�ķ�Ӧ����Ϊ_____��
��4��I�ĺ˴Ź�����������_______�����շ塣G�����������____��ԭ�ӹ�ƽ�档
��5��B+C��M�Ļ�ѧ����ʽΪ_______��
��6��ͬʱ��������������J��ͬ���칹����_____�֣������������칹����
�ٱ���������2��ȡ����
��1mol��������������NaHCO3��Ӧ������2molCO2
��7������������Ϣ�ͺϳ�·�ߣ���HO![]() CH3�ͣ�CH3CO��2OΪ��ʼԭ�ϣ��������Լ���ѡ��������Ʊ�
CH3�ͣ�CH3CO��2OΪ��ʼԭ�ϣ��������Լ���ѡ��������Ʊ�![]() �ĺϳ�·�� _______��
�ĺϳ�·�� _______��
���𰸡� �ڼ����ӣ���2-�����ӣ� 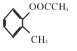 �������ǻ� ȡ����Ӧ 6 19
�������ǻ� ȡ����Ӧ 6 19 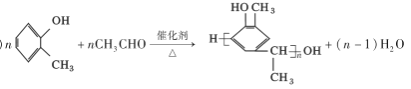 12
12 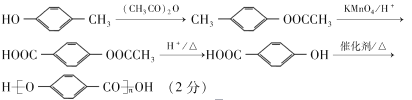
����������A���ܶ�����ͬ�����������ܶȵ�14��������A����Է���������28��A����ϩ����ϩ����������ȩ��C����ȩ����ȩ�����������ᡣ��������Ȼ�����ȡ����Ӧ����E��H���״�����������Ӧ����I����I���ṹ��ʽΪ![]() ��I��E����ȡ����Ӧ����J��B��C��Ӧ����M�������M���ṹ��ʽ��֪B���ڼ����ӡ�������֪��Ϣ��֪B����������Ӧ����F����F���ṹ��ʽΪ
��I��E����ȡ����Ӧ����J��B��C��Ӧ����M�������M���ṹ��ʽ��֪B���ڼ����ӡ�������֪��Ϣ��֪B����������Ӧ����F����F���ṹ��ʽΪ![]() ��F����������Ӧ����ת��Ϊ�Ȼ�����G���ṹ��ʽΪ
��F����������Ӧ����ת��Ϊ�Ȼ�����G���ṹ��ʽΪ![]() ���ݴ˷������
���ݴ˷������
��1���������Ϸ�����֪B�Ļ�ѧ����Ϊ�ڼ����ӡ�F�Ľṹ��ʽΪ![]() ����2������N�Ľṹ��ʽ��֪N�к��������ŵ�����Ϊ�������ǻ�����3���������Ϸ�����֪D��E�ķ�Ӧ����Ϊȡ����Ӧ����4������I�Ľṹ��ʽ��֪��˴Ź�����������6�����շ塣���ڱ�����̼��˫������ƽ���νṹ����G�����������19��ԭ�ӹ�ƽ�棻��5��B+C��M�Ļ�ѧ����ʽΪ
����2������N�Ľṹ��ʽ��֪N�к��������ŵ�����Ϊ�������ǻ�����3���������Ϸ�����֪D��E�ķ�Ӧ����Ϊȡ����Ӧ����4������I�Ľṹ��ʽ��֪��˴Ź�����������6�����շ塣���ڱ�����̼��˫������ƽ���νṹ����G�����������19��ԭ�ӹ�ƽ�棻��5��B+C��M�Ļ�ѧ����ʽΪ ����6���ٱ���������2��ȡ��������1mol��������������NaHCO3��Ӧ������2molCO2��˵������2��ȡ��������ȡ���������ǣ�COOH�ͣ�CH2CH2COOH��COOH�ͣ�CH(CH3)COOH��2����CH2COOH��CH3�ͣ�CH(COOH)2�������ڼ�����֣�����12�֣���7������������Ϣ�����֪ԭ�ϺͲ���ṹ��ʽ��֪�ϳ�·��Ϊ
����6���ٱ���������2��ȡ��������1mol��������������NaHCO3��Ӧ������2molCO2��˵������2��ȡ��������ȡ���������ǣ�COOH�ͣ�CH2CH2COOH��COOH�ͣ�CH(CH3)COOH��2����CH2COOH��CH3�ͣ�CH(COOH)2�������ڼ�����֣�����12�֣���7������������Ϣ�����֪ԭ�ϺͲ���ṹ��ʽ��֪�ϳ�·��Ϊ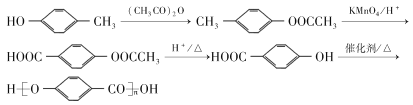 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�������̿�(��Ҫ�ɷ�MnO2�����ʽ���Ԫ��Fe��Al��) �Ʊ�MnSO4��H2O ��һ�ֹ����������£�

��֪��
1�����������з�������Ҫ��Ӧ��ѧ����ʽΪ��MnO2��SO2 =MnSO4
2������Һ����������Ҫ��Mn2+��Fe2+��Al3+��
�ش��������⣺
��1������X���ѡ��
a������ b������ c������
��2�����ʱSO2������Ч����pH���¶ȵĹ�ϵ����ͼ��ʾ��Ϊ���SO2������Ч�ʣ�������˵������� ��
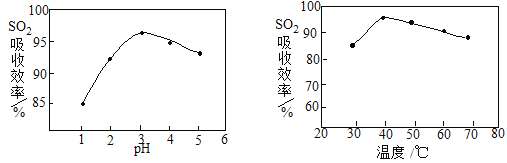
��3�� �����С�������������Ҫ��Ӧ�����ӷ���ʽ�� ��
��4�� ����ʯ�ҽ�����pH���ɽ�������Ľ���Һ��Fe3+��Al3+�γ����������ȥ������Fe3+�Ƿ��������ѷ����� ��
��5�� ��MnSO4�ɲⶨˮ���ܽ����������ǣ�ȡ100 mL ˮ����Ѹ�ټ�������MnSO4��Һ������NaOH��KI��Һ�������������ӡ���ʹ֮��ַ�Ӧ�������ӣ�Ѹ�ټ���������ϡ���ᣬ��ʱ��I2���ɣ�����5.00��10-3 mol��L��1 Na2S2O3��Һ��I2��Ӧ��������Na2S2O3��Һ 12.0 mLʱ��Ӧ��ȫ���йػ�ѧ��Ӧ����ʽ���£�
�� 2Mn2����O2��4OH����2MnO(OH)2����Ӧ�ܿ죩��
�� MnO(OH)2��2I����4H����Mn2����I2��3H2O��
�� I2��2S2O32����S4O62����2I����
����ˮ�����ܽ�����Ũ�ȣ���mg��L��1Ϊ��λ����д��������̡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ���ձ��е����ʾ�������a��b��c��d��e��Ϊʯī�缫��ͨ��һ��ʱ���a�缫���к�ɫ��������������˵����ȷ����

A��B�ձ��м�һ������KCl�����ʹ��Һ�ָ�ԭ״[
B��b�缫��Χ��Һ���
C��A������Cu2+Ũ�Ƚ���
D��d�缫�Ͽ�������ʹʪ��ĵ���KI��ֽ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һԪ��MOH��ROH����Һ�ֱ��ˮϡ�ͣ���ҺpH�ı仯��ͼ��ʾ��������������ȷ����

A��MOH��һ������
B����x�㣬c(M+)=c(R+)
C��ϡ��ǰ��c(ROH)=10 c(MOH)
D��ϡ��ǰMOH��Һ��ROH��Һ����ˮ�������c(OH��)������ǰ�ߵ� 10��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�0.1mol��L��1һԪ��HA���Ũ��KOH��Һ�������Ϻ�������Һ�в�������ּ�Ũ����ͼ��ʾ������˵����ȷ����

A���û����ҺpH=7.0
B��ԭHA��Һ�У�c(HA)��c(H+)��c(A��)
C��ͼ��X��ʾHA��Y��ʾOH����Z��ʾH+
D�������Һ�У�c(X)+x(A��)=c(K+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� X �����о�֤����PCl5 �ڹ���״̬ʱ���ɿռ乹�ͷֱ�Ϊ������������������������ӹ��ɣ����й��� PCl5 ���ƶ���ȷ���ǣ� ��
A. PCl5 �����в��������Ӽ�
B. PCl5 ����������õĵ�����
C. PCl5 ������[PCl4]+��[PCl6]-���ɣ���������Ŀ֮��Ϊ 1:1
D. PCl5 ������[PCl3]2+��[PCl7]2-���ɣ���������Ŀ֮��Ϊ 1:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������۵���ߵĽ���������Ҫ��ս�����ʡ���Ȼ��������Ҫ�����ں��ٿ��У�����Ҫ�ɷ��������̵������Σ�FeWO4��MnWO4������������Si��As�Ļ�����ɺ��ٿ�ұ���ٵĹ����������£�
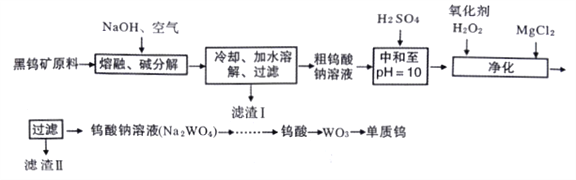
��֪��
������I����Ҫ�ɷ���Fe2O3��MnO2��
�����������У��ٵĻ��ϼ�ֻ�������һ�������ı䡣
�۳���������������ˮ��
��1�������Σ�FeWO4��MnWO4������Ԫ�صĻ��ϼ�Ϊ____����д��MnWO4�����������·�����ֽⷴӦ����Fe2O3�Ļ�ѧ����ʽ__________��
��2�����������������������Һ�м������к���pH=10����Һ�е�����������ȷSiO32-��HAsO32-��HAsO42-�ȣ������������У�����H2O2ʱ������Ӧ�����ӷ���ʽΪ____�����������Ҫ�ɷ���____��
��3����֪�������ƺ�����ƣ�CaWO4�������ܵ���ʣ����ߵ��ܽ�Ⱦ����¶����߶���С����ͼΪ��ͬ�¶���Ca��OH��2��CaWO4�ij����ܽ�ƽ�����ߣ���
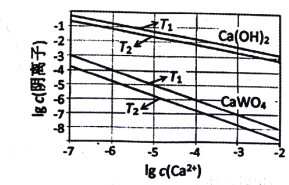
��T1 _____T2���>����<����T1ʱKsp��CaWO4��=____��
�ڽ���������Һ����ʯ����õ���������ƣ�������Ӧ�����ӷ���ʽΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С�����ö����ķ�������Al��Fe�ֱ����ᷴӦ�Ŀ������������ͼ1��ʾ��װ�á�
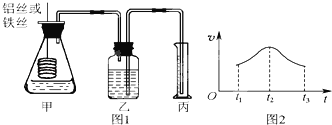
��1�����ͼ1��ʾװ�������Եķ����� ��
��2����Ҫ�Ƚϲ�������Ŀ��������Բ�����ͬʱ����ڲ�������������Ҳ���Բ��� ��
��3��ʵ������˿������������ʣ�v����ʱ�䣨t���Ĺ�ϵ��ͼ2��ʾ����t1��t2ʱ����ڷ�Ӧ�����ӿ����Ҫԭ���� ��t2��t3ʱ����ڷ�Ӧ������������Ҫԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���������ı仯�ͷ�Ӧ�Ŀ����ȽǶ��о���Ӧ��2H2 + O2 = 2H2O�� ��֪�÷�ӦΪ���ȷ�Ӧ����ͼ����ȷ��ʾ�÷�Ӧ�������仯����________�����A����B����
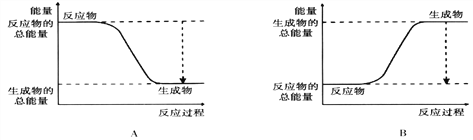
�Ӷϼ��ͳɼ��ĽǶȷ���������Ӧ�������ı仯����ѧ���ļ������±���
��ѧ�� | H��H | O��O | H��O |
����kJ/mol | 436 | 496 | 463 |
������1molˮ���Էų����� _____kJ
��2�����·�Ӧ����ľ̿��ˮ�Ʊ�ˮú�� ������طֽ� ��ըҩ��ը ���������кͷ�Ӧ ����ʯ����ˮ��������ʯ�� �� Ba(OH)2��8H2O��NH4Cl ����̬ˮҺ�������ڷ��ȷ�Ӧ���У�
_________________������ţ���д����Ӧ�Ļ�ѧ����ʽ________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com