
【题目】(1)3.01×1023个氯气分子的物质的量是________,氯原子的物质的量是________。
(2)1.5mol Na2SO4·10H2O中所含的Na+的物质的量是________,所含的SO42-的物质的量是________,所含H2O的数目是______。
(3)一定量的Na2CO3中,碳原子和氧原子的物质的量之比为______。
(4)0.5mol NaOH中含有电子的物质的量是__________,在________mol Na2CO3中所含Na+数目与上述0.5mol NaOH所含Na+数目相等。
(5)12.4g Na2R含0.4mol Na+,则Na2R的摩尔质量为_______,R的相对原子质量为________。含R的质量为1.6g的Na2R,其物质的量为_______。
【答案】0.5mol 1mol 3mol 1.5mol 9.03×1024或15NA 1∶3 10mol 0.25 62g·mol-1 16 0.1mol
【解析】
(1)3.01×1023个氯气分子的物质的量是![]() =0.5mol,氯原子的物质的量是0.5mol×2=1mol;
=0.5mol,氯原子的物质的量是0.5mol×2=1mol;
(2)1.5 mol Na2SO4·10H2O中所含的Na+的物质的量是1.5 mol×2=3mol;所含的SO42-的物质的量是1.5 mol×1=1.5mol;所含H2O的数目是1.5 mol×10×6.02×1023mol-1=9.03×1024个,或15NA个;
(3)一定量的Na2CO3中,碳原子和氧原子的数目比为1∶3,则碳原子和氧原子的物质的量之比为1∶3;
(4)每个中含有20个电子,0.5 mol NaOH中含有电子的物质的量是0.5mol×20=10mol;0.5mol NaOH所含Na+的物质的量为0.5mol,则Na2CO3的物质的量为0.5mol÷2=0.25mol;
(5)12.4g Na2R含0.4 mol Na+,则Na2R的物质的量为0.4mol÷2=0.2mol,摩尔质量为12.4g÷0.2mol=62g·mol-1,Na2R的相对分子质量为62,R的相对原子质量为62-23×2=16;1.6g的R物质的量为![]() =0.1mol,含R的质量为1.6 g的Na2R,其物质的量为0.1mol。
=0.1mol,含R的质量为1.6 g的Na2R,其物质的量为0.1mol。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】脱除烟气中的氮氧化物(主要是指NO和NO2)可以净化空气、改善环境,是环境保护的主要课题。
(1)以漂粉精溶液为吸收剂脱除烟气中的NO,相关热化学方程式如下:
ⅰ.4NO(g) + 3O2(g) + 2H2O(l) = 4HNO3(aq) H1 =﹣423 kJ·mol-1
ⅱ.Ca(ClO)2(aq) = CaCl2(aq) + O2(g) H2 =﹣120 kJ·mol-1
ⅲ.3Ca(ClO)2(aq) + 4NO(g) + 2H2O(l) = 4HNO3(aq) + 3CaCl2(aq) H3
① H3 = _______kJ·mol-1 。
② 反应ⅲ的平衡常数随温度升高的变化趋势是________。
(2)HClO可有效脱除NO,但HClO不稳定,实际应用中常用其盐。C12和Ca(OH)2制取漂粉精的化学方程式是________。
(3)次氯酸盐脱除NO的主要过程如下:
a.NO+HClO = NO2+HCl
b.NO + NO2+H2O 2HNO2
c.HClO+ HNO2 = HNO3+HCl
下列分析正确的是________。
A.烟气中含有的少量O2能提高NO的脱除率
B.NO2单独存在时不能被脱除
C.脱除过程中,次氯酸盐溶液的pH下降
(4)研究不同pH、不同温度下漂粉精溶液对NO脱除率的影响,结果如图1、图2。
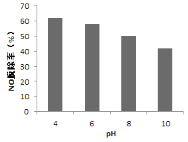

图1 图2
① 图1中,pH降低NO脱除率增大的原因:________。
② 脱除过程中往往有Cl2产生,原因是________(用离子方程式表示)。
③ 图2中,60~80℃ NO脱除率下降的原因:________。(至少答出两点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①5.2g的气态乙炔(C2H2)在氧气中燃烧,生成二氧化碳和液态水,放出260kJ的热量,其热化学方程式为:___________________________________________________________。又知H2O(l)==H2O(g)△H= +44kJ/mol,则11.2L(标准状况)乙炔完全燃烧生成气态水时放出的热量是_________kJ。
②已知:CH4 的燃烧热为890 kJ/mol,H2的热值为142.5kJg-1,现有标准状况下22.4 L CH4和H2的混合气体完全燃烧时,放出的热量为527kJ,求混合气体中CH4 和H2的体积比_____________
③将1mol NO2投入到1L容器中进行 2NO2(g)![]() N2O4(g)反应,达到平衡后将体积压缩到原来的一半再次达到平衡,则第一次平衡体系的颜色比第二次平衡的颜色_____________
N2O4(g)反应,达到平衡后将体积压缩到原来的一半再次达到平衡,则第一次平衡体系的颜色比第二次平衡的颜色_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,A是由X和Y两种短周期元素组成的气体,X的原子序数小于Y,甲、乙、丙分别是X、Y、Z元素对应的单质,Z是地壳中含量最高的元素,它们有如右图所示的转化关系。下列说法不正确的是

A. X、Y、Z三种元素能组成离子化合物
B. 反应②为化合反应,反应③为置换反应
C. 常温常压下,Z的简单氢化物的熔沸点为同族最高
D. 原子半径:Y>Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应时,既要考虑物质变化与能量变化,又要关注反应的快慢与限度。回答下列问题:
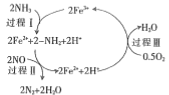
(1)NH3还原NO是重要的烟气脱硝技术,其反应过程与能量关系如下图所示。

①上图中因为改变了反应条件,反应的活化能b___________(填“>”“<”或“=”)a。
②脱硝反应的热化学方程式可表示为反应物→生成物△H=___________(用E1, E2的代数式表示)
③研究发现,一定条件下的脱硝反应过程可能如图所示,根据氧化还原反应中物质的作用,NO为剂____,脱硝总反应的化学方程式为:___________。
(2)一定温度下,将不同物质的量的H2O(g)和CO分别通入容积为1L的恒容密闭容器中,进行反应H2O(g)+CO(g)=CO2(g)+H2(g),得到如表所示的三组数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O(g) | CO(g) | CO(g) | H2(g) | |||
1 | 650 | 2.0 | 4.0 | 3.0 | 1.0 | 5 |
2 | 900 | 1.0 | 2.0 | 1.8 | 0.2 | 4 |
3 | 900 | a | b | c | d | t |
①实验2:4min
②650℃时,若在此容器中充入2.0molH2O(g)、1.0molCO(g)、1.0molCO2(g)和xmolH2(g),要使反应在开始时间向正反应方向进行,则x应满足的条件是___________。
③若a=2.0,b=1.0,则平衡时实验2中H2O(g)和实验3中CO(g)的转化率(α)的关系为α(H2O)___________(填“>”“<”或“=”)α(CO)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关说法正确的是
A.46g N2O4气体中含有的原子数为3NA
B.标准状况下,22.4L SO3中含有SO3分子数为NA
C.50mL 12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
D.用电解法精炼铜的反应中转移0.2NA个电子时,阳极溶解6.4g铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为﹣2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是

A. 晶体中每个K+周围有8个O2﹣,每个O2﹣周围有8个K+
B. 晶体中与每个K+距离最近的K+有8个
C. 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2﹣
D. 晶体中,0价氧与﹣2价氧的数目比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d为四种由短周期元素构成的中性粒子,它们都有14个电子,且都是共价形分子。回答下列问题:
(1)a是单核分子,a单质可用作半导体材料,a原子核外电子排布式为____________________。
(2)b是双核化合物,常温下为无色无味气体。b的化学式为________。人一旦吸入b气体后,就易引起中毒,是因为_______________________________________________而中毒。
(3)c是双核单质,写出其电子式____________________________________________。c分子中所含共价键的类型为____________(填“极性键”或“非极性键”)。c单质常温下性质稳定,不易起反应,原因是______________________________________________。
(4)d是四核化合物,其结构式为____________________________________________;d分子内所含共价键有________个σ键,________个π键;σ键与π键的强度大小关系为σ______π(填“>”、“<”或“=”),原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温25℃下,向一定量的0.1mol/L的BOH溶液中逐滴滴入稀盐酸。溶液中水电离出的氢离子浓度的负对数[用pC表示,pC=-1gc(H+)水]与加入盐酸体积的关系如图所示。下列叙述错误的是( )

A. BOH为弱碱且Kb的数量级为10—5
B. b点溶液呈中性
C. c-d点间溶液中:c(BOH)+c(OH—)>c(H+)
D. c点溶液中水的电离程度最大,且c(B+)<c(Cl—)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com