
����Ŀ��һ������CO2��������̼������ɱ�ĺ�ѹ�ܱ������з�Ӧ��C(s)+CO2(g)![]() 2CO(g)��ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ����ͼ��ʾ��
2CO(g)��ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ����ͼ��ʾ��

��֪�������ѹ��P����=������ѹ��P�������������������˵����ȷ����
A. 550��ʱ��������������壬������ ����С��ƽ�ⲻ�ƶ�
B. 650��ʱ����Ӧ��ƽ���CO2��ת����Ϊ25.0%
C. T��ʱ��������������CO2��CO��ƽ�����淴Ӧ�����ƶ�
D. 925��ʱ����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��KP=24.0P��
���𰸡�B
��������
A�����ڷ�Ӧ������ɱ�ĺ�ѹ�ܱ������н��У���550��ʱ��������������壬�������ݻ�����ʹ��Ӧ������Ũ�ȼ�С����������� ����С�����ڸ÷�Ӧ�������������ķ�Ӧ����Сѹǿ����ѧƽ�������������������Ӧ�����ƶ���A����B������ͼ���֪��650��ʱ����Ӧ��ƽ���CO�����������40%����CO2�����������60%������ƽ��ʱ�����ʵ�����1 mol����Ӧ����CO 0.4 mol�����к���CO2 0.6 mol����Ӧ����0.4 molCO����CO2�����ʵ�����0.2 mol�����CO2ת����Ϊ0.2 mol��(0��6 mol+0.2 mol)��100%=25.0%��B��ȷ��C��T��ʱ��ƽ��ʱCO2��CO�������������50%��������������CO2��CO����ѧƽ�ⲻ�ƶ���C����D��925��ʱ����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��KP=![]() ��D����ѡB��
��D����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йس���������˵���������
A.��ⱥ��ʳ��ˮ���Ի�ý�����
B.þ���ڿ������γ���һ�������ܵ�����Ĥ����þ����Ҫ�����ƵĽ������Ᵽ��
C.���ޡ�������ʢװ���Ũ���ᡢŨ����
D.����ͭ���Ǿ��пɱ仯�ϼ۵Ĺ���Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ƶ�һ�֡����������ͳɱ����-ͭ����ȼ�ϵ�أ��õ��ͨ��һ�ָ��ӵ�ͭ��ʴ����������������зŵ����2Li+Cu2O+H2O=2Cu+2Li++20H��������˵������ȷ����

A. �ŵ�һ��ʱ����Ҳ�ˮ��ҺpH����
B. ������Ӧ�����У�ͭ�൱�ڴ���
C. ͨ����ʱ��ͭ����ʴ���������CuO
D. �ŵ�ʱ�������ĵ缫��ӦʽΪ Cu2O+H2O+2e-=Cu+2OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ�Ǵ�Ԫ�����ڱ��н�ȡ�����ģ��ס��ҡ���Ϊ����������Ԫ�أ�����˵������ȷ����(����)
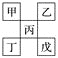
A. ��һ���ǽ���Ԫ�أ�������Աȱ�ǿ
B. �������������ˮ������ǿ����
C. �ҵ��⻯�����Է�����ʽ���ڣ��ҷ��Ӽ�������
D. ���ԭ������һ���Ǽ�5������ԭ�Ӱ뾶�ȼ״�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״����,��ͬ��������������:��Cl2����H2 ��N2����CO2�����������
A. Cl2 B. H2 C. N2 D. CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�������õIJ��ֹ�����ͼ��ʾ������˵��������ǣ� ��
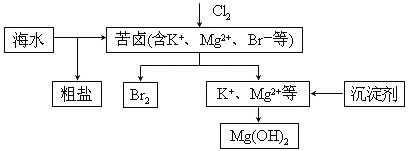
A. ���±��ͨ��Cl2��Ϊ����ȡ��
B. ��ҵ�����г�ѡ��NaOH��Ϊ������
C. ���οɲ��ó��Ӻ��ؽᾧ�ȹ����ᴿ
D. ������һ�����ÿ�����ˮ�������������壬����![]() ���仹ԭ����
���仹ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��ģ�⡰�˹���Ҷ���绯ѧװ������ͼ��ʾ����װ���ܽ�H2O��CO2ת��Ϊ����(C6H12O6)��O2��X��Y����������͵缫������˵����ȷ����
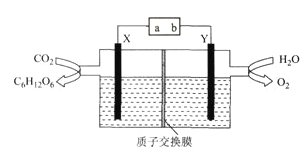
A. ��Դa��Ϊ����
B. ��װ����Y�缫������ԭ��Ӧ
C. X�缫�ĵ缫��ӦʽΪ6CO2+24H++24e-=C6H12O6+6H2O
D. �����ϣ�ÿ����22.4L(��״����)O2,����4mol H+��X������Y����Ǩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ѧ��Fulvio Cacace���˻���˼��������о������N4���ӡ�N4���ӽṹ����ͼ����֪����1mol N��N������942kJ����������1molN��N���ͷ�167kJ��������������Ϣ�����ݣ������Ȼ�ѧ����ʽ��ȷ����
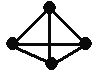
A. 2N2 = N4 ��H = ��882kJ��mol-1
B. N2 (g) = 0.5N4 (g) ��H = +441kJ
C. N2 (g) = 0.5N4 (g) ��H = ��441kJ��mol-1
D. 2N2(g) = N4(g) ��H = +882 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������AG��ʾ��Һ������������ʽΪ![]() �������£�ʵ��������0.1mol��L-1������ζ�10mL0.1mol��L-1MOH��Һ���ζ�������ͼ��ʾ������˵����ȷ����
�������£�ʵ��������0.1mol��L-1������ζ�10mL0.1mol��L-1MOH��Һ���ζ�������ͼ��ʾ������˵����ȷ����
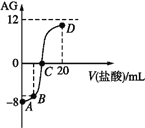
A. MOHΪǿ��
B. C��ʱ����������������10mL
C. ��B�������������Ϊ5mL��������Һ�У�c(M+)+2c(H+)=c(MOH)+2c(OH-)
D. �ζ������д�A�㵽D����Һ��ˮ�ĵ���̶ȣ�A<B<C<D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com