
| A. | NH4+中质子数与电子数 | B. | NH4HSO4晶体中阳离子与阴离子 | ||
| C. | OH-中电子数与中子数 | D. | Na2O2中阳离子与阴离子 |
分析 A.NH4+为带一个正电荷的阳离子,质子数比电子数多一个;
B.NH4HSO4晶体由阳离子NH4+和阴离子HSO4-构成;
C.OH-的电子数为10,中子数为8;
D.Na2O2由钠离子和过氧根离子构成.
解答 解:A.NH4+为带一个正电荷的阳离子,质子数比电子数多一个,故A错误;
B.NH4HSO4晶体中阳离子NH4+和阴离子HSO4-的个数比等于1:1,故B正确;
C.OH-的质子数为8+1=9,电子数为10,中子数为8,故C错误;
D.Na2O2中钠离子与过氧根离子的个数比等于2:1,故D错误;
故选B.
点评 本题考查的是质子数、中子数、电子数之间的关系以及离子化合物中阴阳离子的关系,难度中等,注意Na2O2固体中阴离子是O22-不是O2-.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{22}^{18}$Ti和${\;}_{22}^{50}$Ti原子中均含有22个中子 | |
| B. | ${\;}_{22}^{18}$Ti和${\;}_{22}^{50}$Ti在周期表中位置相同,都在第4纵行 | |
| C. | ${\;}_{22}^{18}$Ti和${\;}_{22}^{50}$Ti的物理性质相同 | |
| D. | ${\;}_{22}^{18}$Ti和${\;}_{22}^{50}$Ti为同一核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 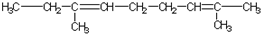 | B. | 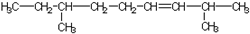 | ||
| C. | 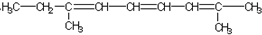 | D. | 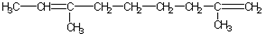 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的最简式:CH2═CH2 | |
| B. | Cl-的离子结构示意图: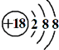 | |
| C. | 二氧化碳的电子式: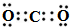 | |
| D. | 原子核内有20个中子的氯原子:${\;}_{17}^{20}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

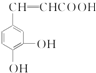 跟碳酸氢钠:
跟碳酸氢钠: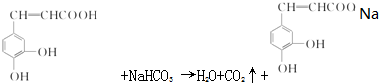 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
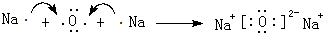 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
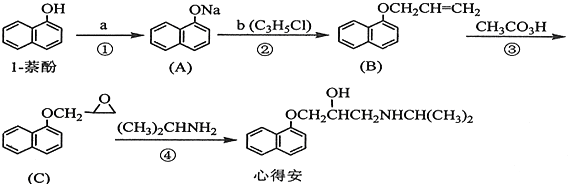
 ;由F生成一硝基产物的化学方程式为
;由F生成一硝基产物的化学方程式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ①和②产物的阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数不同 | |
| C. | 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 | |
| D. | 25℃、101kPa 下,Na2O2(s)+2 Na(s)═2Na2O(s)△H=-317kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com