
| A. | 3s23p2 | B. | 2s22p3 | C. | 3s23p3 | D. | 3s23p4 |
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:实验题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
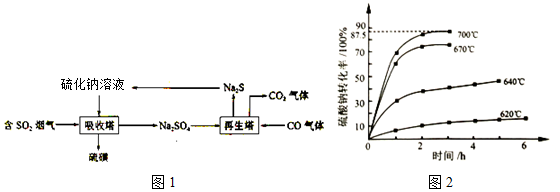
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 测定时刻/s 浓度 | t1 | t2 | t3 | t4 |
| c(A)/(mol•L-1) | 6 | 3 | 2 | 2 |
| c(B)/(mol•L-1) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol•L-1) | 1 | 2.5 | 3 | 3 |
| A. | 在t3 s时反应已经停止 | |
| B. | t3~t4 s内正、逆反应速率不相等 | |
| C. | 在容器中发生的反应为A(g)+B(g)??C(g) | |
| D. | 在t2~t3 s内A的平均反应速率为$\frac{1}{{t}_{3}-{t}_{2}}$ mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥⑦ | B. | ②④⑥ | C. | ③②⑤⑧ | D. | ①④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(NO2)/mol•L-1 | 0.10 | 0.20 | 0.20 |
| C(SO2)/mol•L-1 | 0.10 | 0.10 | 0.20 |
| A. | 容器甲中的反应在前2 min的平均速率v(SO2)=0.05 mol•L-1•min-1 | |
| B. | 达到平衡时,容器丙中正反应速率与容器甲相等 | |
| C. | 温度升至90℃,上述反应平衡常数为1.56,则反应的△H>0 | |
| D. | 容器乙中若起始时改充0.10 mol•L-1 NO2和0.20mol•L-1 SO2,达到平衡时c(NO)与原平衡相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1.12L 氦气所含原子数为0.1NA | |
| B. | 22.4 LHCl溶于水,溶液中H+数为NA | |
| C. | 1.6gNH2-离子所含电子数为NA | |
| D. | 10g D2O所含的中子数为4.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com