
【题目】铁及其化合物在日常生活中有广泛的应用,回答下列问题。
(1)用K2FeO4给水消毒、杀菌时得到的Fe3+可以净水,Fe3+净水原因是____________(用离子方程式表示);但Fe3+净水要腐蚀设备,在腐蚀钢铁设备时,除H+作用外,另一主要原因是________________________________。
(2)钢铁腐蚀造成很大损失,用如图装置防止钢铁腐蚀(烧杯中均为食盐水),X极的电极材料应是________________(填字母)。

A、锌 B、铜 C、银 D、石墨
(3)高铁电池是一种新型的二次电池,电解液为碱性溶液,其反应式如下:
3Zn + 2K2FeO4 + 8H2O![]() 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
3Zn(OH)2 + 2Fe(OH)3 + 4KOH
①写出该电池放电时的正极反应式______________________________。
②如图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有______。

(4)从保护环境的角度考虑,制备K2FeO4较好的方法为电解法,其装置如图所示。

①石墨做电解池的______极(填“阴”或“阳”),溶液中OH-向_____移动(填“铁丝网”或“石墨”)
②电解过程中阳极的电极反应式为______________________________。
③若维持电流强度为6A,电解5小时,理论上可制得K2FeO4的质量为_________g(已知F=96500 C/mol,结果保留1位小数)
(5)已知25℃时Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5 mol/L 500 mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入____mL 2 mol/L的盐酸(滴加盐酸前后,溶液总体积不变)。
【答案】Fe3+ +3H2O![]() Fe(OH)3(胶体)+3H+ 2Fe3+ + Fe = 3Fe2+ A FeO42- + 3e- + 4H2O = Fe(OH)3 + 5OH- 使用时间长;工作电压稳定 阴 铁丝网 Fe - 6e- + 8OH- = FeO42- + 4H2O 36.9 g 12.5
Fe(OH)3(胶体)+3H+ 2Fe3+ + Fe = 3Fe2+ A FeO42- + 3e- + 4H2O = Fe(OH)3 + 5OH- 使用时间长;工作电压稳定 阴 铁丝网 Fe - 6e- + 8OH- = FeO42- + 4H2O 36.9 g 12.5
【解析】
本题主要考查原电池、电解池的相关知识,由金属的活泼性确定原电池的正负极、电解池的阴阳极,或者由元素的化合价升降确定正负极和阴阳极。
(1)高铁酸钾被还原后的产物Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,可起到净水的作用,Fe3+水解离子方程式为:Fe3++3H2OFe(OH)3(胶体)+3H+,故答案为Fe3++3H2OFe(OH)3(胶体)+3H+;
铁离子具有氧化性,钢铁设备中的Fe会与铁离子反应生成亚铁离子,离子方程式是:2Fe3++Fe=3Fe2+,故答案为2Fe3++Fe=3Fe2+;
(2)装置为原电池,若用如图装置保护铁,X极的电极材料应比铁活泼,可以选择锌,故答案为A;
(3)①放电时,正极得到电子发生还原反应,FeO42-获得电子生成Fe(OH)3,应有水参与反应,同时生成氢氧根离子,正极电极反应式为:FeO42- + 3e- + 4H2O = Fe(OH)3 + 5OH-;
故答案为FeO42- + 3e- + 4H2O = Fe(OH)3 + 5OH-;
②由图可知,高铁电池的优点有放电时间长,工作电压稳定等优点;
故答案为使用时间长;工作电压稳定;
(4)①图为电解池,铁是活泼金属失去电子发生氧化反应,作为电解池的阳极,石墨得到电子发生还原反应,作为阴极,溶液中的阴离子向阳极移动,阳离子向阴极移动,故OH-向阳极即铁丝网移动,故答案为阴;铁丝网;
②K2FeO4能消毒、净水的原因是高价铁具有氧化性,能消毒杀菌,生成Fe3+形成胶体,具有吸附水中悬浮物的净水作用,电解时阳极Fe失去电子发生氧化反应,阳极的电极反应式为Fe - 6e- + 8OH- = FeO42- + 4H2O,故答案为Fe - 6e- + 8OH- = FeO42- + 4H2O;
③维持电流强度为6A,电解5小时,时间为18000s,F=96500 C/mol,Q=It=6C/s×18000s,通过的电子为![]() ,则理论上可制得K2FeO4的最大质量=
,则理论上可制得K2FeO4的最大质量=![]() ≈36.9g,
≈36.9g,
故答案为36.9g;
(5)要使溶液不产生沉淀,则溶液中c(OH-)=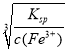 =
=![]() mol/L =2×10-13mol/L,溶液中c(H+)=
mol/L =2×10-13mol/L,溶液中c(H+)=![]() =
=![]() =0.05mol/L,加入稀盐酸体积=
=0.05mol/L,加入稀盐酸体积=![]() =12.5mL;
=12.5mL;
故答案为12.5mL。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:Zn(s) +![]() O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
Hg(l) +![]() O2(g) = HgO(s) ΔH2=-90.7kJ/mol
O2(g) = HgO(s) ΔH2=-90.7kJ/mol
由此可知Zn(s) + HgO(s) = ZnO(s) + Hg(l)的ΔH3,其中ΔH3的值是
A.-260.4 kJ/molB.-254.6 kJ/molC.-438.9 kJ/molD.-441.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列溶液中微粒浓度关系一定正确的是( )
A.0.1mol·L-1Na2CO3溶液中,加水稀释,![]() 的值减小
的值减小
B.0.1mol·L-1的硫酸铝溶液中:c(SO42-)>c(Al3+)>c(H+)>c(OH-)
C.pH=7的氨水与氯化铵的混合溶液中:c(Cl-)>c(NH4+)
D.pH=2的醋酸溶液和pH=12的NaOH溶液等体积混合:c(Na+)=c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C. pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D. 向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关叙述正确的是
A. 0.1 mol·L1 Na2S溶液与0.1 mol·L1 NaHS溶液等体积混合:3c(Na+)2c(HS)=2c(S2)+2c(H2S)
B. 向20 mL 0.1 mol·L1 NH4HSO4溶液中滴入0.1 mol·L1 NaOH溶液 20 mL:2c(![]() )=c(NH3·H2O)+c(
)=c(NH3·H2O)+c(![]() )
)
C. 10 mL 0.1 mol·L1 CH3COONa溶液与6 mL 0.2 mol·L1盐酸混合:c(Cl)>c(Na+)>c(OH)>c(H+)
D. 0.2 mol·L1 NaHCO3溶液和0.1 mol·L1 NaOH溶液等体积混合:3c(![]() )+6c(H2CO3)c(Na+)=3c(OH)3c(H+)
)+6c(H2CO3)c(Na+)=3c(OH)3c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列关于该装置的说法错误的是

A.溶液中的![]() 移向电极Y
移向电极Y
B.若两电极分别为铁棒和碳棒,则X为铁棒且X为原电池的负极
C.X极上发生的是氧化反应,Y极上发生的还原是反应
D.若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D在元素周期表中的位置如图所示,其中A所处的周期序数与主族序数相等。
B | D | |
A | C |
请回答下列问题:
(1)A在周期表中的位置是_____;D单质的电子式为_____。
(2)C、D的最简单氢化物中,稳定性较强的是_____(填化学式);C的最高价含氧酸是____(填“离子”或“共价”)化合物。
(3)A、D的简单离子的半径大小关系为:_____(用化学式填空);用一个反应可证明元素B、D的非金属性强弱关系,该反应的化学反应方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
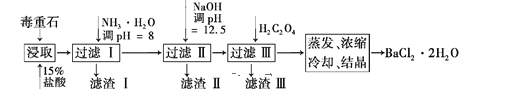
(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而_____________。
(2) 加入NH3·H2O调节pH=8可除去____(填离子符号),此时,溶液中该离子的浓度为______mol·L-1。再加入NaOH调pH=12.5,溶液内剩余的阳离子中______完全沉淀,____部分沉淀 (填离子符号)。加入H2C2O4时应避免过量,原因是____。已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9, Ksp[Fe(OH)3] =2.6×10-39。

(3由于Na2S2O5具有毒性,因此国家对其在食品中的用量有严格的规定。某化学兴趣小组在测定某白葡萄酒中Na2S2O5的残留量时,取40mL葡萄酒样品于锥形瓶中,滴入几滴淀粉溶液,用0.02 mol·L-1碘的标准溶液滴定至终点,消耗碘标准溶液5mL,则滴定终点的现象为__________,Na2S2O5的含量是以SO2来计算的,则该样品中Na2S2O5的残留量以![]() 计为______
计为______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为氯化钠的晶体结构模型,下列说法不正确的是
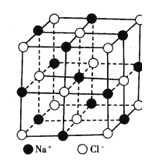
A.NaC1晶体中Na+与C1— 的个数比为1:1
B.每个Na+周围距离最近的C1— 数为6
C.和Na+距离相等且最近的C1— 构成的多面体是正八面体
D.每个Na+周围距离最近的Na+数为8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com