
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 置换反应 | B. | 分解反应 | C. | 化合反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
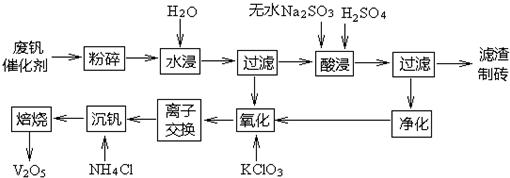
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人体不能缺碘,需要正常补碘.“加碘食盐”中的“碘”是指碘元素 | |
| B. | 进行焰色反应实验时,蘸取样品之前需要用稀硫酸溶液清洗铂丝 | |
| C. | “绿色化学”的理想在于不再使用有毒、有害的物质,不再产生废物 | |
| D. | 水壶中产生的水垢可用食醋清洗除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下11.2LNO2分子 | B. | 0.3mol H2SO4分子 | ||
| C. | 1L 0.5mol/LBa(OH)2溶液 | D. | 12.04×1023个SO3分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| B. | 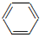 +HO-Na2$→_{60℃}^{浓硫酸}$ +HO-Na2$→_{60℃}^{浓硫酸}$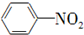 +H2O +H2O | |
| C. | CH2═CH2+H2O$\stackrel{催化剂}{→}$CH3-CH2OH | |
| D. | CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
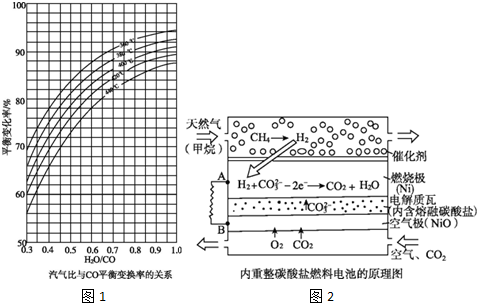
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com