
分析 在一定条件下,向体积为2L的容器中加入3mol O2和6mol SO2,O2和SO2浓度分别为1.5mol/L、3mol/L,2min时测得SO2的浓度下降为1mol•L-1,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L):3 1.5 0
变化量(mol/L):2 1 2
2min时(mol/L):1 0.5 2
(1)根据v=$\frac{△c}{△t}$计算v(SO3);
(2)根据n=cV计算平衡时SO3的物质的量.
解答 解:在一定条件下,向体积为2L的容器中加入3mol O2和6mol SO2,O2和SO2浓度分别为1.5mol/L、3mol/L,2min时测得SO2的浓度下降为1mol•L-1,则:
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L):3 1.5 0
变化量(mol/L):2 1 2
2min时(mol/L):1 0.5 2
(1)2min内,平均反应速率v(SO2)=$\frac{2mol/L}{2min}$=1mol/(L.min),
故答案为:1mol/(L.min);
(2)平衡时SO3的物质的量=2mol/L×2L=4mol,
答:平衡时SO3的物质的量为4mol.
点评 本题考查化学平衡计算、反应速率计算,比较基础,有利于基础知识的巩固.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 在能使pH试纸变红的溶液中:Fe2+、Na+、Cl-、NO3- | |
| B. | 在含有S2-离子的溶液中:NH4+、K+、Cl-、SO42- | |
| C. | 在由水电离出的c(H+)=10-12mol•L-1的溶液中Na+、Ba2+、Cl- | |
| D. | 在无色溶液中:NH4+、Mg2+、SO42-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓 度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
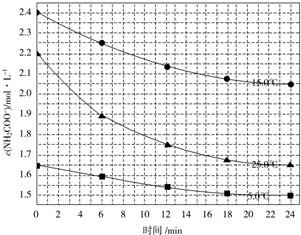
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
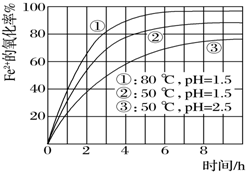 为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如图所示,判断下列说法错误的是( )
为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如图所示,判断下列说法错误的是( )| A. | pH越小氧化率越小 | |
| B. | 温度越高氧化率越大 | |
| C. | Fe2+的氧化率除受pH、温度影响外,还受其它因素影响,如浓度等 | |
| D. | 实验说明降低pH、升高温度有利于提高Fe2+的氧化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸见光分解:4HNO3$\frac{\underline{\;光照\;}}{\;}$4NO2↑+O2↑+2H2O | |
| B. | 往NaOH溶液中通入过量二氧化硫:2NaOH+SO2═Na2SO3+H2O | |
| C. | SO2气体通入BaCl2溶液中产生白色沉淀:SO2+BaCl2+H2O═BaSO3↓+2HCl | |
| D. | Fe与稀H2SO4反应的化学方程式为:2Fe+3H2SO4═Fe2(SO4)3+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
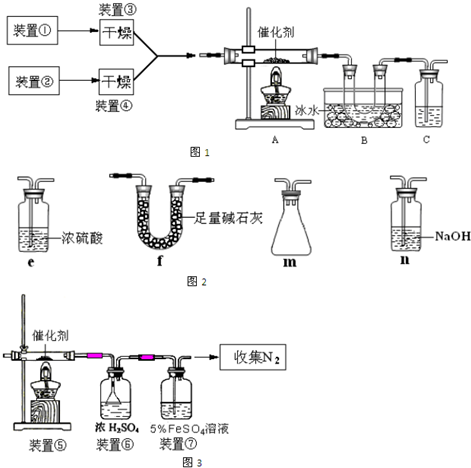
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 温度℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述反应是熵增反应 | |
| B. | 在80℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol•L-1,则此时反应逆向进行 | |
| C. | 25℃时,反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数是0.5 | |
| D. | 恒温恒容,向已达平衡的容器中再充入少量Ni(CO)4(g),达到新平衡时,CO的体积百分含量将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
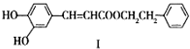 不饱和酯类化合物在药物、涂料等方面应用广泛.
不饱和酯类化合物在药物、涂料等方面应用广泛. .
.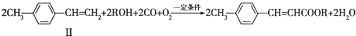
 (写1种);由Ⅳ生成Ⅱ的反应条件为氢氧化钠的醇溶液、加热.
(写1种);由Ⅳ生成Ⅱ的反应条件为氢氧化钠的醇溶液、加热.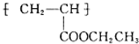 可用于制备涂料.其单体的结构简式为CH2=CHCOOCH2CH3.利用类似反应①的方法,仅以乙烯为有机原料合成该单体,涉及的反应方程式为CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{一定条件}{→}$2CH2=CHCOOCH2CH3+2H2O.
可用于制备涂料.其单体的结构简式为CH2=CHCOOCH2CH3.利用类似反应①的方法,仅以乙烯为有机原料合成该单体,涉及的反应方程式为CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,2CH2=CH2+2CH3CH2OH+2CO+O2$\stackrel{一定条件}{→}$2CH2=CHCOOCH2CH3+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2:9 | B. | 3:2 | C. | 2:1 | D. | 8:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com