
2、下列实验仪器不宜直接用来加热的是
A.试管 B.坩埚 C.蒸发皿 D.烧杯
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015-2015湖南省高二12月学科联赛化学试卷(解析版) 题型:填空题
20.已知H2A在水中存在以下平衡:H2A? ?H++HA-,HA-?
?H++HA-,HA-? ?H++A2-。回答以下问题:
?H++A2-。回答以下问题:
(1)已知常温下,H2A的钙盐(CaA)饱和溶液中存在平衡:
CaA(s) Ca2+(aq)+A2-(aq) ΔH > 0。
Ca2+(aq)+A2-(aq) ΔH > 0。
①温度升高时,Ksp_______(填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c (Ca2+)________,原因是___________ (用文字和离子方程式说明)。
(2)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式______。若某CuSO4溶液中c (Cu2+)=0.02 mol/L,如果要生成Cu(OH)2沉淀,应调整溶液pH,使之大于 (已知Ksp[Cu(OH)2]=2.0×10-20)。
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二上学期第二次统练化学试卷(解析版) 题型:选择题
6.某化学反应的能量变化如下图所示。下列有关叙述正确的是

A.该反应为放热反应
B.E2可表示形成新的化学键所释放的能量
C.该反应的反应热ΔH=E1-E2
D.加入催化剂可同等程度的降低E1、E2
查看答案和解析>>
科目:高中化学 来源:2014-2015云南省景洪市高一上学期期中化学试卷(解析版) 题型:选择题
14.下列电离方程式的书写正确的是
A.Na2CO3===2 Na++3CO32- B.Al2(SO4)3===Al3++SO42-
C.H2SO4===2H++SO42- D.Na2SO4===2Na++SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省文登市高一上学期期末考试化学试卷(解析版) 题型:填空题
(7分)下图是用废铜料(铁、铜混合物)来生产胆矾(CuSO4·5H2O)的过程,请根据图示回答下列问题。

(1)试剂X是___________(填名称)。
(2)途径Ⅱ的化学方程式为____________________________________。
(3)有关途径Ⅰ和途径Ⅱ的说法正确是___________(填编号)
a.途径Ⅰ的操作步骤比途径Ⅱ多,因此采取途径Ⅱ更合理
b.途径Ⅰ相比途径Ⅱ节省原料,且不产生污染
c.相同质量的单质A完全反应生成硫酸铜的量与途径无关
d.每生成1mol B,消耗1mol氧化剂,转移2mol电子
(4)称取25g胆矾,加热冷却后称量固体的质量减少了7.2g,则所得固体的化学式为___________。
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省文登市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.铝片放入NaOH溶液中:2Al+2OH-+6H2O=2[ Al(OH)4] -+3H2↑
B.NaHCO3电离:NaHCO3 Na++ H++CO32-
Na++ H++CO32-
C.醋酸与碳酸钠反应:2H++CO32-= CO2↑+H2O
D.铜与氯化铁溶液反应:Fe3+ + Cu = Cu2+ + Fe2+
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省文登市高二上学期期末考试化学试卷(解析版) 题型:填空题
(9分)A~G有以下转化关系:

已知:①E能发生银镜反应;
②C中苯环上有三个互不相邻的取代基
③G分子遇氯化铁溶液显紫色。
(1)B的结构简式为_______________,G的结构简式为________________。
(2)C→D的反应类型是____________,E分子中含氧官能团的名称是_______________。
(3)B物质有许多同分异构体,除B外其他三种含有苯环的同分异构体的结构简式分别为
_________________、________________、__________________。
(4)D→E的化学方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省临沂市高二上学期期末化学试卷(解析版) 题型:填空题
(14分)用电化学原理研究金属铝具有重要的意义。
(1)已知:
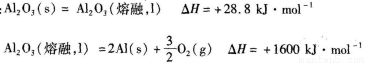
①工业上利用惰性电极电解熔融的Al2O3冶炼铝,每消耗1000kJ电能时,生成27g铝,则电解过程中能量利用率为____。

③利用Al2O3制备无水AlCl3的反应为
 。反应达平衡时,加入焦炭能使平衡向正反应方向移动,理由是__________.
。反应达平衡时,加入焦炭能使平衡向正反应方向移动,理由是__________.
(2)为了防止钢材腐蚀,常采用电解熔融盐法在钢材表面镀铝。熔融盐中铝元素和氯元素仅以 形式存在。如下图所示:
形式存在。如下图所示:

①钢材表面镀铝时,铝应接电源的________极。
②试分析电镀铝时不用氯化铝水溶液作电解液的原因:_______________.
(3)铝一空气-NaOH溶液组成的铝电池性能优越,可用于电动汽车。写出该电池的负极电极反应式______:
(4)铝可用于处理银器表面的黑斑(Ag2S)。将银器置于铝制容器里的食盐水中并与铝接触,形成原电池,可将Ag2S转化为Ag,该过程中食盐水的作用为_______________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com