
 ��ְٷְټ���ϵ�д�
��ְٷְټ���ϵ�д� �����ƻ���ĩ��̶�100��ϵ�д�
�����ƻ���ĩ��̶�100��ϵ�д� �ܿ���ȫ��100��ϵ�д�
�ܿ���ȫ��100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����0.1 mol��L-1 KNO3��Һ�еμ�ϡ����ʹ��Һ��pH��5����ʱ���Һ��c(K+)��c(NO3�D) |
| B��25 ��ʱ��0.1 mol��L-1��ˮ��0.05 mol��L-1��ˮ��c��OH�D��֮����2��1 |
| C��0.1 mol��L-1NH4Cl��Һ��c��Cl�D����c��NH4+�� |
| D����CH3COONa��Һ�м�������CH3COOHʹ���ҺpH��7,��ʱ��Һ��c(Na+)��c(CH3COO�D) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������Һ�����Ӽ����㣺c��CH3COO����=c��Na+�������Һһ�������� |
| B������Һ��һ�����㣺 c��CH3COO������c��CH3COOH����c��OH������c��H+�� |
| C����Һ����������֮��������㣺c��Na+����c��OH-����c��CH3COO������c��H+�� |
| D������Һ�е�������CH3COONa��CH3COOH������Һ�����Ӽ�һ�����㣺 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���������� | B������ | C�������� | D������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
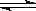 H++HA-��HA-
H++HA-��HA-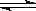 H++A2-����֪��ͬŨ��ʱH2A��HA-�����룬����ͬ�¶�ʱ������Һ��H2AŨ��������
H++A2-����֪��ͬŨ��ʱH2A��HA-�����룬����ͬ�¶�ʱ������Һ��H2AŨ��������| A��0��01 mol��L��H2A��Һ |
| B��0��01 mol��L��NaHA��Һ |
| C��0��02 mo|��L��NaOH��Һ��0��02 mol��L��NaHA��Һ�������� |
| D��0��02 mol��L��HCl��Һ��0��04 mol��L��NaHA��Һ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��c(Na+��+ c(H+��= c(OH-��+ c(CH3COO-�� |
| B��c(Na+����c(CH3COO-����c(H+����c(OH-�� |
| C��c(OH-��= c(H+��+ c(CH3COOH�� |
| D��c(CH3COOH��+ c(CH3COO-��= c(Na+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ���ữѧʽ | CH3COOH | HCN | H2CO3 |
| ����ƽ�ⳣ��(25��) | 1.8��10��5 | 4.9��10��10 | Ka1��4.3��10��7 Ka2��5.6��10��11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢� | B���� | C���ۢ� | D���� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com