
下列有关说法正确的是
A.25℃时,pH=5盐酸和pH=9的氨水,两溶液中水的电离程度不同
B.25℃时,Ksp(A)> Ksp(B),说明化合物A的溶解度比化合物B的大
C.常温下pH=4的盐酸中:c(H+)=c(OH-)+c(Cl-)
D.在NH4Cl溶液中加入适量硫酸,可使c(NH4+):c(Cl-)接近1:1
CD
解析试题分析:由于盐酸是酸,而氨水是碱,故两者都是抑制水的电离,所以25℃时,pH=5盐酸和pH=9的氨水,两溶液中水的电离程度是相同的,故A错误;溶解度的大小与溶度积没有必然的联系,故.25℃时,Ksp(A)> Ksp(B),不能确定化合物A的溶解度比化合物B的大,故B错误;常温下pH=4的盐酸中,根据电荷守恒可以得到,c(H+)=c(OH-)+c(Cl-),故C正确;NH4Cl为强酸弱碱盐,其水溶液中由于铵根离子的水解而呈酸性,加入硫酸可以抑制其铵根离子的水解,所以加入适量硫酸,可使c(NH4+):c(Cl-)接近1:1,故D正确,所以本题的正确答案为CD。
考点:强弱电解质、电荷守恒、盐类水解
点评:本题考查了强弱电解质、电荷守恒、盐类水解,这些考点均是高考考查的重点和难点,本题要理解的是酸和碱都能够抑制水的电离,无论是强酸还是弱酸,该题难度中等。


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
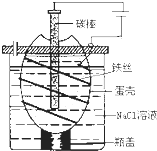 工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
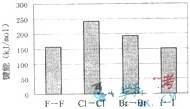 (2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.
(2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com