
【题目】在下列物质的转化关系中,A是一种固体物质,E是一种白色沉淀,据此填写下列空白:
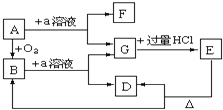
(1)B的化学式是________,B在固态时属于________晶体,1mol 含有的共价键数目是______NA。
(2)E的化学式是_________。
(3)B和a溶液反应的离子方程式是_______________________________
(4)A和a溶液反应的化学方程式是___________________________________
【答案】SiO2 原子 4 H2SiO3 SiO2+2OH-=SiO32-+H2O Si+2NaOH+H2O=Na2SiO3+2H2↑
【解析】
A是一种固体单质,与氧气反应得到B为氧化物,E是一种白色沉淀且不溶于盐酸,E加热分解得到B,所以E为H2SiO3,结合转化关系,可知A为Si,B为SiO2,a为强碱溶液,如NaOH溶液,G为Na2SiO3,D为H2O,F为H2。
(1)由上述分析可知,B是SiO2,SiO2由硅原子和氧原子通过共用电子对形成空间网状结构,在固态时属于原子晶体,每个硅原子和四个氧原子形成四个共价键,1mol 含有的共价键数目是4NA。故答案为:SiO2;原子;4;
(2)由上述分析可知,E为H2SiO3,故答案为:H2SiO3;
(3)二氧化硅与强碱溶液反应生成硅酸盐与水,反应的离子方程式为:SiO2+2OH-=SiO32-+H2O;
故答案为:SiO2+2OH-=SiO32-+H2O;
(4)Si与氢氧化钠反应生成硅酸钠与氢气,反应方程式为:Si+2NaOH+H2O=Na2SiO3+2H2↑,
故答案为:Si+2NaOH+H2O=Na2SiO3+2H2↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如下所示。
达到平衡,正反应速率随时间变化的示意图如下所示。

A. 反应在c 点达到平衡状态
B. 反应物浓度:![]() 点小于
点小于![]() 点
点
C. 反应物的总能量低于生成物的总能量
D. ![]() 时,SO2的转化率:
时,SO2的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的二氧化硫气体和二氧化碳气体的比较中,正确的是( )
A.密度比为11∶16B.物质的量比为16∶11
C.体积比为11∶16D.分子个数比为16∶11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林(Warfarin)又名杀鼠灵,为心血管疾病的临床药物。其合成路线(部分反应条件略去) 如下所示:
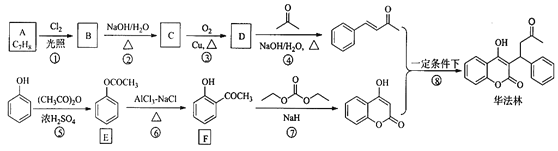
回答下列问题:
(1)A 的名称为________,E 中官能团名称为________。
(2)B 的结构简式为________。
(3)由 C 生成 D 的化学方程式为___________
(4)⑤的反应类型为_________,⑧的反应类型为________。
(5)F 的同分异构体中,同时符合下列条件的同分异构体共有___________种。
a.能与 FeCl3 溶液发生显色反应 b.含有-CHO
其中核磁共振氢谱为五组峰的结构简式为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。
(1)使用甲醇汽油可以减少汽车尾气对环境的污染。工业上在 200℃和 10MPa 的条件下可用甲烷和氧气通过铜制管道反应制得甲醇,已知一定条件下,CH4 和 CH3OH 的燃烧热分别 784kJ/mol 和 628kJ/mol 则 2CH4(g)+O2(g)![]() 2CH3OH(g) △H=_____。
2CH3OH(g) △H=_____。
(2)二甲醚也是清洁能源。用合成气在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g) CH3OCH3(g) +H2O(g) △H<0。某温度下,,将 2.0molCO(g)和 6.0molH2(g)充入容积为 2L 的密闭容器中,反应到达平衡时, 改变压强和温度,平衡体系中 CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是_____。
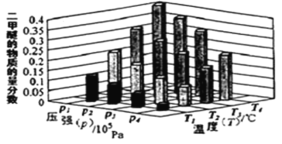
A.p3>p2,T3>T2
B.p1>p3,T1>T3
C.p1>p4,T2>T3
D.p2>p4,T4>T2
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g)![]() 2CO2(g) +N2(g);
2CO2(g) +N2(g);
①200K、pPa时,在一个容积为 2L的恒温密闭容器中充入 1.5molNO 和 2.0molCO,开始反应至 2min 时测得 CO 转化率为 30%,则用N2表示的平均反应速率为v(N2)=_________;反应达到平衡状态时,测得二氧化碳为 0.8mol,则平衡时的压强为起始压强的_________倍(保留两位小数)。
②该反应在低温下能自发进行,该反应的ΔH_____0(填“>”、“<”)
(4)一定温度下,将NO2与SO2以体积比 1:2 置于密闭容器中发生反应NO2(g)+SO2(g) SO3(g)+NO(g),达到平衡时SO3的体积分数为 25%。该反应的平衡常数K= ______。
(5)利用原电池反应可实现NO2 的无害化,总反应为6NO2+ 8NH3=7N2+12H2O,电解质溶液为碱性。工作一段时间后,该电池正极区附近溶液 pH ____(填“变大”、“变小”或“不变”),负极电极反应式为 ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从废旧锂电池中回收Li2SO4、CuSO4、CoSO4等有价金属的工艺流程如下:
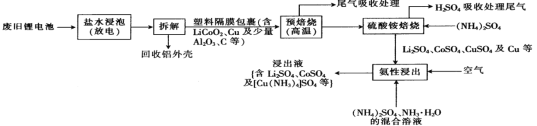
已知:“盐水浸泡”是将废旧锂电池置于食盐水中浸泡放电;“氨性浸出”时溶液呈弱碱性。
回答下列问题:
(1)“盐水浸泡”进行放电,放电的目的是________________________。
(2)“预焙烧”的目的是____________________,可用于吸收该过程产生的尾气的试剂是____________________。
(3)“硫酸铵焙烧”时,硫酸铵的作用是______________________________;“H2SO4吸收处理尾气”后的溶液可循环利用,则“硫酸铵焙烧”时的尾气中含___________(填化学式)。
(4)“氨性浸出”时,通入空气的目的是__________________________。
(5)“氨性浸出”时,Cu单质被浸出为[Cu(NH3)4]SO4,该反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化锰为原料制取高锰酸钾晶体的实验流程如图所示,下列有关说法正确的是
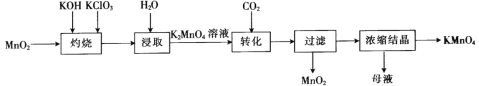
A.“灼烧”时,可在玻璃坩埚中进行
B.“浸取”时,可用无水乙醇代替水
C.“转化”反应中,通入CO2的目的是提供还原剂
D.“浓缩结晶”的目的是分离提纯KMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果发现了原子序数为114的元素,下列对它的叙述中正确的是( )
①位于第七周期②非金属元素③最外电子层有4个电子④没有放射性⑤属于第IVA族元素⑥属于锕系元素.
A.①③⑤B.②⑥C.①③⑥D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究链状有机物X(H2C2O4)的结构及性质:
结构
已知:双键碳上连羟基不稳定。
(1)推测X可能的结构___________ 、____________(填结构简式)(X分子中无-O-O-结构)。
核磁共振氢谱显示X分子中只有一种氢原子,可以确定X分子为乙二酸。
性质探究:
查资料可知:乙二酸(HOOC-COOH)俗称草酸,易溶于水,属于二元中强酸,酸性强于碳酸,其熔点为101.5℃,在157℃升华。
类别角度:
(2)用化学方程式表征乙二酸类别通性中的两种性质:_________ 。
(3)在通性研究过程中,同学们发现:等物质的量的草酸和NaOH混合,溶液呈酸性,其原因可能与_____机理最接近。
a HCl溶液显酸性 b 苯酚溶液显酸性 c NaHSO3溶液显酸性
化合价角度:
(4)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMO4溶液,振荡,发现溶液的紫红色褪去,说明乙二酸具有___________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____MnO4-+ ____H2C2O4+ ____H+=____ Mn2++____CO2↑+____H2O。
特性角度:
(5)同学网上查阅乙二酸性质,发现了以下实验:(夹持装置未标出)
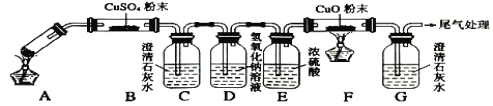
A中盛放少量草酸晶体,实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红,据此回答:上述装置中,D的作用是__________。写出上述实验中草酸发生反应的方程式_______。
(6)小结草酸的化学性质___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com