
【题目】下列物质能由两种单质直接化合生成的是( )
A.FeCl3B.NO2C.SO3D.CuS
科目:高中化学 来源: 题型:
【题目】A是一种常见的单质,B、C为中学化学常见的化合物,A、B、C均含有元素X。它们有如图所示的转化关系(部分产物及反应条件已略去)。下列说法中不正确的是 ( )
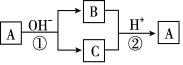
A. X元素可能为Al B. X元素一定为非金属元素
C. A可能是Cl2 D. 反应①和②一定为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们的饮食追求是“吃得营养,吃出健康”,下列相关说法不正确的是( )
A.每天都应摄入一定量的蛋白质
B.油脂会使人发胖,故禁食油脂
C.过多摄入微量元素不利于健康
D.每天食用少量纤维素有利于健康
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用漂白粉溶液浸泡过的有色布条,如晾晒在空气中,过一段时间,其漂白效果更好的原因是:
A. 漂白粉被氧化了
B. 漂白粉和空气中的二氧化碳充分反应生成了次氯酸
C. 有色布条被空气中的氧气氧化
D. 漂白粉溶液失去了部分水分,浓度增大了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两只密闭容器A和B,A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等物质的量SO3气体,并使A和B容积相等(如图所示)在保持400℃的条件下使之发生如下反应:2SO2+O2 ![]() 2SO3 . 则下列描述正确的是( )
2SO3 . 则下列描述正确的是( ) 
A.达到平衡所需要的时间:A容器更短
B.达到平衡时:B容器中SO3的转化率更大
C.达到平衡时:A容器中SO2的物质的量更多
D.达到平衡后,向两容器中分别通入等量的氦气,A容器中SO3的体积分数增大,B容器中SO3的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质(如下图所示)。下列说法正确的是

A.由氯化钠制备纯碱的过程中,利用了物质溶解度的差异
B.用Cl2制备漂白粉时,是将Cl2通入澄清石灰水中
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.图示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲图是部分短周期元素的常见化合价与原子序数的关系图:
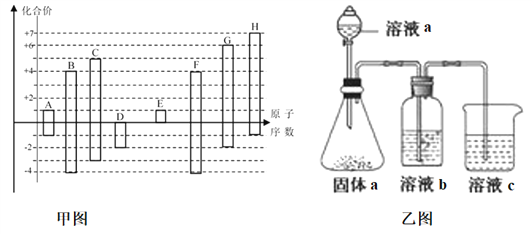
请回答下列问题:
(1)D元素在周期表中的位置为___________,D和G的简单氢化物中沸点高的是___________ (写化学式),A和E形成的化合物的电子式为_____________。
(2)D、E、G、H的简单离子半径由大到小的顺序为__________________________。(用化学式表示)
(3)二元化合物X是含有C元素的18电子分子,1molX(l)在25℃ 101kPa下完全燃烧放出622kJ的热量,写出表示X燃烧热的热化学方程式________________________________。
(4)H的最高价氧化物对应的水化物的浓溶液不稳定,受热可分解,产物之一是H的单质,且当有28mol电子转移时,常温共产生9mol气体,写出该反应的化学方程式___________________________________。
(5)由上述元素中的几种组成a、b、c各物质,某同学设计实验用乙图装置证明元素B、C、F的非金属性强弱(其中溶液b和溶液c均为足量)。
①溶液a和b分别为________,________(填化学式)。
②溶液c中的离子方程式为__________________________________________。
③请从原子结构的角度解释非金属性C>B的原因 ____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体成分。
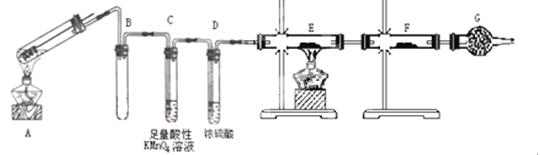
(1)填写装置的作用:B___________,C___________,G___________。
(2)证明有S02生成的实验现象是_____________________。
(3)可以证明所产生的气体中含有H2的实验现象是:E中:___________,F中:_________。如果去掉装置D,还能否根据F中的现象判断气体中有H2?_________(填能”或“不能”),原因是_________________________。
(4)反应后A的溶液中含有Fe3+和Fe2+,检验其中Fe2+的方法是____________。
(5)若将铁丝换成铜丝,反应后的溶液没有出现预计的蓝色溶液,而出现了大量白色固体。原因是___________________________;要确认有CuSO4生成,待试管冷却后,____________。写出铜与浓硫酸反应的离子方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱酸H2A溶液中存在H2A、HA-和A2- 三种形态的粒子,其物质的量分数 δ( X)=  随溶液pH变化的关系如图所示,下列说法正确的是( )
随溶液pH变化的关系如图所示,下列说法正确的是( )

A. 曲线①代表的粒子是HA-
B. 0.1mol·L -1的NaHA溶液中存在:c(Na+ )+c(A2- )+c(H2A)+c(HA- )>0.2 mol·L-1
C. 若图中的a值为4.2,则H2A的第二步电离平衡常数Ka1为10-4.2
D. 随着PH的升高,  的比值先增大后减小
的比值先增大后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com