
【题目】下列各组反应中,反应物的相对用量对产物组成无影响的是
A. 铁与稀硝酸 B. 硫化氢与氧气 C. 1,3-丁二烯与溴 D. 过氧化钠与二氧化碳
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A.0.1 mol/L的(NH4)2SO4溶液:c(SO![]() )>c(NH
)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.0.1 mol/L的NaHCO3溶液:c(Na+)=c(HCO![]() )+c(H2CO3)+2c(CO
)+c(H2CO3)+2c(CO![]() )
)
C.将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得溶液:c(Na+)+c(H+)=c(A-)+c(Cl-)
D.0.02mol/L CH3COOH溶液和0.01 mol/L NaOH溶液等体积混合所得溶液:
2c(H+)+ c(CH3COOH) = c(CH3COO- ) +2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质的工业制备所用主要原料(括号内物质)不符合事实的是
A. 碘(海带) B. 溴(晒盐后的卤水) C. 乙烯(乙醇) D. 烧碱(氯化钠)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铂电极电解下列溶液时,阴极和阳极上的主要产物分别为H2和O2的是 ( )
A. 稀HCl溶液 B. 稀Na2SO4溶液 C. CuCl2溶液 D. AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)0.5molN2的质量是,在标准状况下所占的体积约为,所含的原子数目约为。
(2)同温同压下,同质量的O2和O3,分子数之比为,原子数之比为,体积之比,密度之比为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中产生的废气、废液、废渣直接排放会造成污染,很多都经过吸收转化为化工产品。
I.利用电化学原理吸收工业生产中产生的SO2、NO,同时获得Na2S2O4和NH4NO3产品的工艺流程图如图(Ce为铈元素)。

请回答下列问题:
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式: 。
(2)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示:
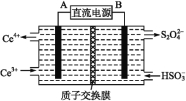
右侧反应室中发生的主要电极反应式为 。
(3)已知进入装置Ⅳ的溶液中NO2-的浓度为0.4 mol·L-1,要使1 m3该溶液中的NO2-完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2的体积为 L。
II.以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
![]()
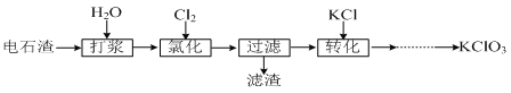
(4)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 (填序号)。
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(5)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为
6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤。滤渣的主要成分为 (填化学式)。
(6)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100gL1,从该溶液中尽可能多地析出KClO3固体的方法是 。

(7)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) △H=-271kJ/mol
5CaO(s)+H3PO4(l)+HF(g)=Ca5(PO4)3F(s)+5H2O(l) △H=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )

A.反应①②③④⑤均属于氧化还原反应,反应③还属于置换反应
B.反应⑤说明该条件下铝可用于制熔点较高的金属
C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1
D.反应①中氧化剂与还原剂的物质的量之比为1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知图一表示的是可逆反应CO(g)+H2(g)![]() C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)![]() N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是( )
N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是( )

A. 图一t2时改变的条件可能是升高了温度或增大了压强
B. 若图一t2时改变的条件是增大压强,则反应的ΔH增大
C. 图二t1时改变的条件可能是升高了温度或增大了压强
D. 若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com