
某硫酸铵样品,测得其中氮元素的质量分数为20%,其样品中可能含有的另一种氮肥是( )
A.CO(NH2)2(尿素) B.NH4HCO3
C.NH4NO3 D.NH4Cl
科目:高中化学 来源: 题型:
 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:| 氢氧化钠溶液体积/mL | 40.00mL | ||
| 样品质量/g | 7.750 | 15.50 | 23.25 |
| 氨气质量/g | 1.870 | 1.870 | 1.700 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.CO(NH2)2(尿素) B.NH4HCO3
C.NH4NO3 D.NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
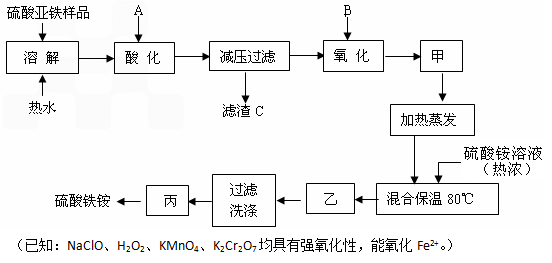
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com