
【题目】如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应。钠及其氧化物的物质的量 均为0.1 mol,水的质量为100 g。下列说法正确的是

A.甲、乙、丙都属于氧化还原反应
B.甲反应的离子方程式为Na+2H2O![]() Na++2OH-+H2↑
Na++2OH-+H2↑
C.丙充分反应,能产生0.05 mol O2,转移电子0.1 mol
D.甲、乙、丙充分反应后所得溶液的质量分数分别为w1、w2、w3,则2w1=w2=w3
【答案】C
【解析】
A.氧化钠和水反应生成氢氧化钠,该反应中没有电子转移,不属于氧化还原反应,故A错误;
B.甲的离子方程式为2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.过氧化钠和水反应时,过氧化钠中O元素化合价由-1价变为0价和-2价,过氧化钠既是氧化剂又是还原剂,且有一半的过氧化钠作氧化剂、有一半的过氧化钠作还原剂,所以丙充分反应,能产生0.05molO2,转移电子物质的量=0.05mol×2=0.1mol,故C正确;
D.钠、氧化钠、过氧化钠和水反应的方程式分别如下:
Na+H2O=NaOH+![]() H2↑,溶液增加的质量=m(Na)-m(H2)=2.3g-0.1g=2.2g;
H2↑,溶液增加的质量=m(Na)-m(H2)=2.3g-0.1g=2.2g;
Na2O+H2O=2NaOH,溶液增加的质量=m(Na2O)=0.1mol×62g/mol=6.2g;
Na2O2+H2O=2NaOH+![]() O2↑,溶液增加的质量=m(Na2O2)-m(O2)=m(Na2O)=6.2g;
O2↑,溶液增加的质量=m(Na2O2)-m(O2)=m(Na2O)=6.2g;
所以溶液增加的质量大小顺序为:钠<氧化钠=过氧化钠,
根据钠原子守恒知,0.1mol的钠、氧化钠、过氧化钠、溶于水所得氢氧化钠的物质的量分别为:0.1mol、0.2mol、0.2mol,通过以上分析可知,0.1mol的钠、氧化钠、过氧化钠分别溶于水所得溶液的质量分数分别为:w1=![]() 、w2=
、w2=![]() 、w3=
、w3=![]() ,则:2w1>w2=w3,故D错误;
,则:2w1>w2=w3,故D错误;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】海洋植物如海带和海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋中提取碘的流程如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ―→
―→![]()
某化学兴趣小组将上述流程②、③设计成如下图所示操作。
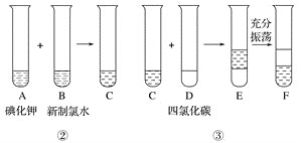
已知过程②发生反应的化学方程式为Cl2+2KI===2KCl+I2
回答下列问题:
(1)写出提取过程①、③中实验操作的名称:①____________,③____________。
(2)在灼烧过程中,使用到的实验仪器有酒精灯、____________、____________(除泥三角外)。
(3)F中下层液体的颜色为________色,上层液体中溶质的主要成分为____________。
(4)从F中得到固态碘还需进行的操作是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列变化的方程式是
A.HSO3-电离:HSO3-+H2O![]() SO32-+ H3O+
SO32-+ H3O+
B.NaHCO3溶液中加入少量盐酸:CO32-+2H+=CO2↑+ H2O
C.KI 溶液中加入 H2SO4 和 H2O2: 2I-+H2O2 =I2+2OH-
D.用石墨电极电解 CuCl2溶液 :Cu2++2C1-+2H2O![]() Cu(OH)2↓+H2↑ + Cl2 ↑
Cu(OH)2↓+H2↑ + Cl2 ↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较结合e-能力的相对强弱:Cl2__________S(填“>”或“<”);用一个离子方程式说明Cl2和S结合e-能力的相对强弱_______。
(2)KCN 是离子化合物,各原子均满足8 电子稳定结构。写出 KCN的电子式______。
(3)在常压下,CBr4的沸点(190℃)比CCl4的沸点(76.8℃)高。主要原因是 ____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列有关说法正确的是 ( )
A. 在常温常压下,11.2LO2含有的分子数为0.5NA
B. 71gCl2所含原子数为2NA
C. 标准状况下,22.4LH2O含有的分子数为1NA
D. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液450mL和0.5 mol·L-1硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
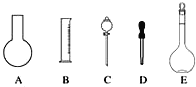
(1)如图所示的仪器中配制溶液肯定不需要的是_______(填序号),配制上述溶液还需用到的玻璃仪器是_________(填仪器名称)。
(2)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为______g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度_____(填“偏高”、“偏低”或“不变”);
③若NaOH固体溶解后立即移入容量瓶→洗涤烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度________(填“偏高”、“偏低”或“不变”)。
(3)在配制硫酸溶液时:
①需量取质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积_______ml;
②在配制硫酸溶液时需先在烧杯中将浓硫酸进行稀释,稀释时的操作方法是_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块表面已部分被氧化为氧化钠的钠块1.08g放入20g水中,得到标准状况下氢气224mL。求:
①被氧化前钠块的质量__________________。
②所得溶液中溶质的质量分数_____________(计算结果均保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室通常用氧化剂+浓盐酸![]() 金属氯化物+水+氯气的原理制取少量Cl2。现将一定质量的NaClO放入100 mL 10.00 mol·L-1的浓盐酸中,生成的Cl2在标准状况下的体积为1.12 L。试计算(反应前后溶液的体积变化忽略不计):
金属氯化物+水+氯气的原理制取少量Cl2。现将一定质量的NaClO放入100 mL 10.00 mol·L-1的浓盐酸中,生成的Cl2在标准状况下的体积为1.12 L。试计算(反应前后溶液的体积变化忽略不计):
(1)反应过程中,被氧化的HCl的物质的量为____mol。
(2)反应后溶液中HCl的物质的量浓度为____mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
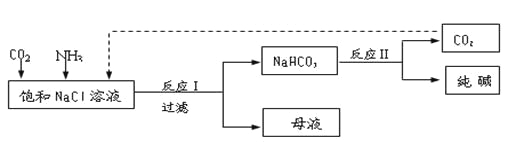
已知NaHCO3在低温下溶解度较小。
反应Ⅰ:NaCl+CO2+NH3+H2O![]() NaHCO3↓+NH4Cl,处理母液的两种方法:
NaHCO3↓+NH4Cl,处理母液的两种方法:
(1)向母液中加入石灰乳,可将其中________循环利用。
(2)向母液中通入NH3,加入细小的食盐颗粒并降温,可得到NH4Cl晶体。试写出通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式 ___________。
Ⅱ.某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。

(1)装置丙中冷水的作用是_________;
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有_______、洗涤、灼烧。NaHCO3转化为Na2CO3的化学方程式为______;
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3 样品的组成进行了以下探究。
取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。
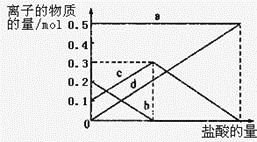
则曲线a对应的溶液中的离子是___________(填离子符号下同);曲线c对应的溶液中的离子是___________;该样品中NaHCO3和Na2CO3的物质的量之比是___________; 21
(4)若取21.0 g NaHCO3固体,加热了t2rnin后,剩余固体的质量为l4.8 g。如果把此剩余固体全部加入到200 mL 2 molL—1的盐酸中,则充分反应后溶液中H+ 的物质的量浓度为____________(设溶液体积变化忽略不计)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com