
【题目】下列说法中正确的是( )
A.由分子构成的物质中一定含有共价键
B.正四面体结构的分子中键角一定是109028’
C.形成共价键的元素不一定是非金属元素
D.CO2 和SiO2都是直线型分子
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用固体氢氧化钠配制一定物质的量浓度溶液时,下列操作能导致溶液浓度偏高的是( )
A.在烧杯中溶解时,有少量液体溅出B.样品中混有碳酸钠固体
C.容量瓶使用前未经干燥D.定容时俯视容量瓶刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为﹣24.2℃,不易溶于水,易溶于乙醇和丙醇等有机溶剂. Ⅰ.实验室制取CH3Cl的原理是CH3OH+HCl(浓) ![]() CH3Cl+H2O.具体步骤如下:
CH3Cl+H2O.具体步骤如下:
①干燥ZnCl2晶体;
②称取24g研细的无水ZnCl2和量取20mL浓盐酸放入圆底烧瓶,同时量取一定量的甲醇放入分液漏斗中;
③将分液漏斗里的甲醇逐滴滴入烧瓶中并加热,待ZnCl2完全溶解后有CH3Cl气体逸出,可用排水法收集.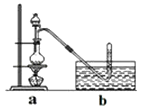
请回答:
(1)实验室干燥ZnCl2晶体制得无水ZnCl2的方法是
(2)反应过程中滴入烧瓶中甲醇的体积比盐酸少(甲醇与浓盐酸的物质的量浓度接近)其理由是 .
(3)实验室为何用排水法收集CH3Cl?
(4)Ⅱ.据某资料记载,CH4分子中的一个H原子被Cl原子取代后,其稳定性受到影响,可被强氧化剂酸性高锰酸钾氧化.现有四只洗气瓶;分别盛有以下试剂: A.1.5%KMnO4(H+)溶液; B.蒸馏水;C.5%Na2SO3溶液; D.98%H2SO4
为证实这一理论的可靠性,请从上面选择最恰当的洗气瓶,将a装置生成的气体依次通过洗气瓶(填洗气瓶编号),如果观察到则证实上述资料的正确性.
(5)写出洗气瓶中发生反应的离子方程式(C元素的氧化产物为CO2):
(6)如果CH3Cl是大气的污染物,上述洗气瓶之后还应接一只盛的洗气瓶.
(7)某小组同学取VmL被CH3Cl污染的水样与锥形瓶中,用0.10molL﹣1酸性KMnO4溶液进行滴定,实验所得数据如表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.02 | 20.00 | 19.98 |
第一次实验数据出现异常,造成这种异常的原因可能是(填字母代号).
a.锥形瓶洗净后未干燥 b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定过程中振荡锥形瓶时有液体溅出 d.滴定终点时仰视读数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“ ![]() ”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的TS核素符号是 ![]() Ts
Ts
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列冶炼金属的方法正确的是( )
A.电解MgO制取Mg
B.加热条件下用CO还原Ag2O制取Ag
C.在Al和F2O3反应中,生成11.2gFe,转移电子数为0.6NA
D.电解NaCl溶液制取Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法不正确的是( )
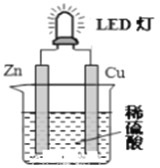
A. 铜片表面有气泡生成,且溶液中SO42-向该电极移动
B. 装置中存在“化学能→ 电能→ 光能”的转换
C. 如果将硫酸换成柠檬汁,导线中仍有电子流动
D. 如果将锌片换成铁片,电路中的电流方向不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是( )
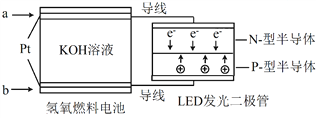
A. 电路中的电子从负极经外电路到正极,再经过KOH溶液回到负极,形成闭合回路
B. a处通入氢气, b处通氧气,该装置将化学能最终转化为电能
C. 电池放电后, OH-的物质的量浓度减小
D. 通入O2的电极发生反应:O2 + 4e- = 2O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,工业上合成尿素(H2NCONH2)的反应如下:2NH3(I)+CO2(g)H2O(I)+H2NCONH2(I)△H=﹣103.7kJmol﹣1试回答下列问题:
(1)写出一种有利于提高尿素的产率的措施是 .
(2)合成尿素的反应在进行时分为如下两步: 第一步:2NH3(I)+CO2(g)H2NCOONH4(I)(氨基甲酸铵)△H1
第二步:H2NCOONH4(I)H2O(I)+H2NCONH2(I)△H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.2L的密闭容器中投入4mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如图甲所示:
①●●代表的物质为(填化学式)
②已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第步反应决定,反应进行到10min时到达平衡.反应进行到10min时测得●●所代表的物质的量如图所示,则该物质表示的表示化学反应的速率为molL﹣1min.L﹣1
③第二步反应的平衡常数K2随温度的变化如乙图所示,则△H1 0 (填“>”“<”或“=”).
④第一步反应在(填“较高”或“较低”)温度下有利该反应自发进行.
(3)已知: N2(g)+O2(g)=2NO(g)△H=+180.6kJmol﹣1
N2(g)+3H2(g)=2NH3(g)△H=﹣92.4kJmol﹣1
2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJmol﹣1
则4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com