
甲、乙、丙、丁四种短周期元素可以组成下列框图中除Br2和L以外的物质,其原子序数依次增大。甲和乙可形成常见液态化合物K,固体A中含有丙元素的+1价阳离子,其电子层结构与氖原子相同,丁元素原子的最外层电子数是其电子层数的2倍。反应(II)是海水提溴过程中涉及的重要反应。在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出):

试回答:
(1)甲元素的名称为 ,溴元素在周期表的位置 ,丁元素的阴离子结构示意图为 。
(2)A的电子式为 ,所含化学键类型为 。
(3)乙、丙、丁三元素的离子半径由大到小的顺序为(用元素符号表示) 。
(4)反应(I)的化学方程式为 。
(5)反应(II)的离子方程式为 。
科目:高中化学 来源: 题型:
氢溴酸在医药和石化工业上有广泛用途。如图所示是模拟工业制备氢溴酸粗产品并精制的流程:

根据上述流程回答下列问题:
(1)混合①中发生反应的离子方程式为_______________________________________。
(2)混合①中使用冰水的目的是____________________________________________。
(3)操作Ⅲ一般适用于分离________混合物(填序号)。
a.固体和液体 b.固体和固体
c.互不相溶的液体 d.互溶的液体
(4)混合②中 加入Na2SO3的目的是__________________________________________。
加入Na2SO3的目的是__________________________________________。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验进行探究:
甲同学假设工业氢溴酸呈淡黄色是因为其中含有Fe3+,则用于证明该假设所用的试剂为________,若假设成立可观察到的现象为________________;乙同学假设工业氢溴酸呈淡黄色是因为其中含有______________________,其用于证明该假设所用的试剂为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下面四个反应中,反应类型与其它三种不同的是
A.CH3CH2OH + CH3COOH CH3COOCH2CH3 + H2O
B.CH3CH2OH CH2=CH2↑+H2O
CH2=CH2↑+H2O
C.2CH3CH2OH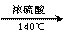 CH3CH2OCH2CH3 + H2O
CH3CH2OCH2CH3 + H2O
D. CH3CH2OH + HBr CH3CH2Br + H2O
CH3CH2Br + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应物的总能量一定大于生成物的总能量的是 ( )
A.所有燃烧反应 B.所有不需要加热的反应
C.所有物质的溶解过程 D.所有氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10。A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数。则下列叙述正确的是( )
A.B、D的最高价氧化物中,B、D与氧原子形成离子键
B.四种元素的原子半径:A<B<C<D
C.D元素处于元素周期表中第3周期第IV族
D.一定条件下,B单质能置换出D单质,C单质能置换出A单质
查看答案和解析>>
科目:高中化学 来源: 题型:
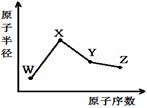
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图。已知W的一种核素的质量数为18,中子数为10;X原子和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是
A.对应简单离子半径:X>W>Y>Z
B.Y的氧化物能与Z或X的最高价氧化物对应的水化物反应
C.X、W两元素形成的二元化合物中一定含有离子键
D.对应气态氢化物的稳定性W>Y,对应气态氢化物的熔沸点Y>W
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨工业、硫酸工业的生产工艺流程大致为:
合成塔和接触室中的反应分别为:
 |
N2(g)+3H2(g)  2NH3(g) △H﹤0; 2SO2(g)+O2(g)
2NH3(g) △H﹤0; 2SO2(g)+O2(g)  2SO3(g) △H﹤0
2SO3(g) △H﹤0
(1)写出流程中设备的名称:B ,X 。
(2)写出硫铁矿和空气反应的化学方程式
(3)进入合成塔和接触室中的气体都要进行热处理,最理想的热处理方法是 。
(4)采用循环操作可提高原料的利用率,下列生产中,采用循环操作的
是 (填序号)。
①硫酸工业 ②合成氨工业 ③硝酸工业
(5)工业上常用98.3%的浓硫酸吸收SO3而不用稀硫酸或水的原因是 。
(6)工业生产中常用氨——酸法进行尾气脱硫,以达到消除污染、废物利用的目的。硫酸工业尾气中的SO2经处理可以得到一种化肥,该肥料的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
对某酸性溶液(可能含有Br-、SO 、H2SO3、NH
、H2SO3、NH )分别进行如下实验:
)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在原溶液中是否存在的是 ( )
A.Br- B.SO
C.H2SO3 D.NH
查看答案和解析>>
科目:高中化学 来源: 题型:
 以下关于右图说法正确的是
以下关于右图说法正确的是
A.右图表明催化剂可以改变反应的热效应
B.右图表示某反应能量的变化与生成物状态无关
C.右图表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
D.右图表明化学反应不仅遵循质量守恒定律,也遵循能量守恒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com