
| A、HF、HCl、HBr、HI的还原性依次增强,热稳定性依次减弱 | B、P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 | C、IA族的金属单质与水反应比同周期IIA族的金属单质剧烈 | D、除稀有气体外,第三周期元素的原子半径和离子半径随原子序数的增加而减小 |


科目:高中化学 来源: 题型:


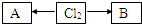 ,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式
,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省潍坊市高三12月阶段测试化学试卷 题型:选择题
元素周期律和元素周期表是学习化学的重要工具,下列说法不正确的是
A.同周期的主族元素中,ⅦA族元素的原子半径最小
B.元素周期表中从ⅢB到ⅡB十个纵列的元素都是金属元素
C.室温条件下,O族元素的单质都是气体
D.ⅥA元素的原子,其半径越大,越容易得到电子
查看答案和解析>>
科目:高中化学 来源:2013届广东省高一下学期期中考试化学(文)试题 题型:选择题
下列关于元素周期表和元素周期律的说法错误的是
A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B.第二周期元素从Li到F,非金属性逐渐增强
C.卤素随核电荷数增加氢化物越来越稳定
D.O与S为同主族元素,且O比S的非金属性强
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现 |
| B.元素的性质随着原子序数的增加而呈周期性变化 |
| C.俄国化学家道尔顿为元素周期表的建立做出了巨大的贡献 |
| D.同一主族的元素从上到下,金属性呈周期性变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com