
【题目】有关铜锌原电池电极的判断正确的是
A.锌电极是负极B.发生还原反应的是负极
C.质量减轻的电极是正极D.电子流出的电极是正极
科目:高中化学 来源: 题型:
【题目】如图所示原电池装置,回答下列问题:
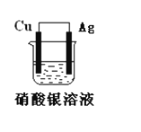
(1)此电池的负极是:______,正极的电极反应式是:________。
(2)该电池工作一段时间后,装置中出现的现象________,将银电极小心取出洗涤并晾干,经称量发现比原来增重了5.4g。则导线中通过的电子的物质的量为 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,不能满足组内任意两种物质在一定条件下均能发生反应的是
物质 | 甲 | 乙 | 丙 |
A | H2SO4 | NH4HCO3 | Ba(OH)2 |
B | H2S | NaOH | SO2 |
C | NH3 | NO2 | HNO3 |
D | Na | H2O | Cl2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列指定条件的溶液中,一定能大量共存的离子组是()
A. ![]() 溶液中:
溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B. 无色溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
C. 室温下,![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() .
.
D. 滴入KSCN溶液显红色的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中![]() 下列分析正确的是
下列分析正确的是![]()
![]()

A. ![]() 闭合,铁棒上发生的反应为
闭合,铁棒上发生的反应为![]()
B. ![]() 闭合,石墨棒周围溶液pH逐渐降低
闭合,石墨棒周围溶液pH逐渐降低
C. ![]() 闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D. ![]() 闭合,电路中通过
闭合,电路中通过![]() 个电子时,两极共产生
个电子时,两极共产生![]() 气体
气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如图4所示:

(1)Cu元素基态原子的外围电子排布式为______________。
(2)元素C、N、O的第一电离能由大到小排列顺序为_______________。
(3)配合物A中碳原子的轨道杂化类型为_______________________。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有![]() 键的数目为____________mol。
键的数目为____________mol。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:____________(写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图2所示,则该化合物的化学式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe2+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现取两份100mL溶液进行如下实验:
①第一份加过量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,同时得到溶液甲。
②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g。
③第二份加足量BaCl2溶液后,得白色沉淀,加盐酸不溶解,经过滤、洗涤、干燥后,称得沉淀质量为13.98g。
(1)由上述实验可确定溶液中一定不存在的离子是______________,不能确定是否存在的离子是_______,检验该离子需使用何种试剂或方法______________。
(2)由题意可知此溶液呈________性(答酸性、碱性或中性),上述金属离子中既能被氧化又能被还原的离子是___________。
(3)钾离子是否存在(是或否):_______,若存在其浓度范围为(没有则不答):_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com