
| A. | 增大C的浓度 | B. | 增大压强 | C. | 升高温度 | D. | 加催化剂 |
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液中粒子的数目减小 | |
| B. | 再加入CH3COONa固体能促进醋酸的电离 | |
| C. | 稀释醋酸溶液,溶液中所有离子的浓度均降低 | |
| D. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀盐酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸钙溶于稀盐酸中 CO32-+2H+═CO2↑+H2O | |
| C. | 碳酸氢钠溶液与盐酸反应 HCO3-+H+═CO2↑+H2O | |
| D. | 氧化铜与盐酸反应 O2-+2H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
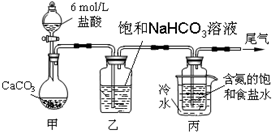
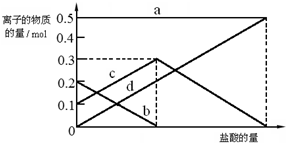
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应的本质是化合价生了变化 | |
| B. | 化合价升高的物质被氧化 | |
| C. | 得到电子的物质被氧化 | |
| D. | 氧化还原反应中,先有氧化后有还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氟化氢在所有卤化氢中热稳定性最强 | |
| B. | 浓H2SO4加入氟化钙固体中,加热,有氟化氢气体产生 | |
| C. | 100ml 0.1 mol•Lˉ1氢氟酸中,c(H+)小于0.1 mol•Lˉ1 | |
| D. | 测得常温下0.1mol•L-1NaF溶液的pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH减小 | |
| C. | 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入少量固体硫酸钠,c(H+)=10-7 mol•L-1,Kw不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6g CO和22.4LCO2中含有的碳原子数一定相等 | |
| B. | ngCl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为$\frac{35.5m}{n}$ | |
| C. | 标准状况下,11.2L M气体分子的质量为16g,则M气体的摩尔质量是32 | |
| D. | 现有CO、CO2、O3三种气体,它们均含有1 molO,则三种气体的物质的量之比为3:2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com