
| A. | 吸烟产生的尼古丁和一氧化碳属于室内空气污染物 | |
| B. | 吸入一氧化碳、焦油、尼古丁可导致肺部发生病变 | |
| C. | 吸烟会影响中学生健康人格的形成 | |
| D. | 吸烟对公共环境没有影响 |
分析 吸烟能产生一氧化碳、尼古丁等4000多种化学物质,很多都是有害物质,因此吸烟有害健康,其中一氧化碳、焦油、尼古丁可导致肺部发生病变,而且吸烟直接影响学生的人生观和世界观的形成,由此分析解答.
解答 解:A、一氧化碳、尼古丁有毒,所以属于室内空气污染物,故A正确;
B、长期吸烟能产生一氧化碳、尼古丁,可导致肺部发生病变,故B正确;
C、吸烟直接影响学生的人生观和世界观的形成,和健康人格的形成,故C正确;
D、吸烟能产生一氧化碳、尼古丁等4000多种化学物质,很多都是有害物质,所以对公共环境造成极大影响,故D错误;
故选D.
点评 本考点考查的是吸烟对空气的污染及其危害,要求学生禁止吸烟,保护环境,从自我做起.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解质 | B. | 弱酸盐 | C. | 强碱盐 | D. | 碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 酸雨主要是空气中的SO2,溶于雨水中形成的 | |
| B. | 破坏臭氧层的主要物质是氟氯烃等物质 | |
| C. | 温室效应主要是因空气中CO2浓度增高造成的 | |
| D. | 居室装修释放的甲醛不会伤害人体健康 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

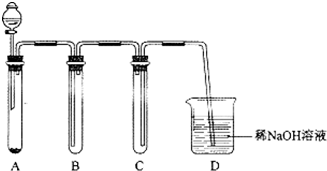
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
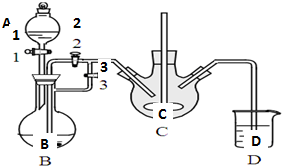 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2 | B. | CO2和O2 | C. | NO2和O2 | D. | NO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com