
����Ŀ��������(SO2C12)���Ȼ�����(SOC12)�ڿ�������ˮ�����������ҷ�Ӧ������������������������(SO2C12)�������Ȼ������Ȼǻ�������������ҩƷ��Ⱦ�ϡ�������Լ��ȡ��ϳɵķ�ӦʽΪ: SO2(g) + Cl2(g)![]() SO2Cl2(l) ��H=-197.3 kJ��mol-1
SO2Cl2(l) ��H=-197.3 kJ��mol-1
���� | �۵�/�� | �е�/�� | �������� |
SO2C12 | -54.1 | 69.1 | �ֽ���SO2C12 |
�ϳ�SO2C12��װ������ͼ��ʾ(�г�������ʡ�ԣ�����ش��й�����:
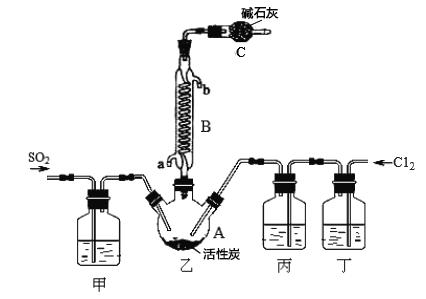
(1)���±���ѡ����Ӧ��װ��������:
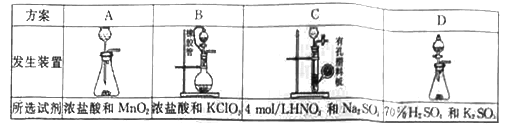
���Ʊ�SO2ѡ________(����ĸ)��
��д������ѡװ����ȡCl2�����ӷ���ʽ_________________��
(2)�ϳ�SO2C12��װ��ͼ������B������Ϊ_________________������ʢ�ŵ���_____________��
(3)��Ӧ���������л������뿪��ʵ����������� _______________��
(4)ͼ��װ��C��������__________________��
(5)Ϊ��߱�ʵ���еIJ���,��ʵ������л���Ҫע���������(ֻ����������)__________��
(6)�Ȼ�����(SOCl2)��ˮ��Ӧ�Ļ�ѧ����ʽΪ_____������A1C13��Һ���ܵõ���ˮAlCl3����SOC12��AlCl3 6H2O�Ļ�ϼ��ȣ��ɵõ���ˮA1C13���Խ���ԭ��__________��
���𰸡� D ClO3-+5Cl-+6H+=3Cl2��+3H2O ���������� ����ʳ��ˮ ���� ����δ��Ӧ�������Ͷ�������ֹ�����е�ˮ������������ƿ �����������ʣ��������˿죻������ƿ���¶Ƚϸߣ����ʵ����£���ͨ��ˮ���ٽ���ʵ�� SOCl2+H2O=SO2��+2HCl�� SOCl2��AlCl3��6H2O�еĽᾧˮ���ã�������ˮAlCl3��SO2��HCl���壬����SO2��HCl����AlCl3ˮ��
��������(1)��A��Ũ������������̳����²���Ӧ��������������B��Ũ����������ط�Ӧ��������������C�������ܹ������ɵĶ����������������ᣬ����D��70%��������������ط�Ӧ���ɶ���������ȷ����ѡD��
��A��Ũ������������̳����²���Ӧ��Ӧ��ѡ��B����Ӧ�����ӷ���ʽΪClO3-+5Cl-+6H+=3Cl2��+3H2O���ʴ�Ϊ��ClO3-+5Cl-+6H+=3Cl2��+3H2O��
(2)�ϳ�SO2C12��װ��ͼ������BΪ���������ܣ�Ũ������лӷ��ԣ����ɵ������л����Ȼ��⣬����ʢ�ű���ʳ��ˮ�������������е��Ȼ��⣬�ʴ�Ϊ�����������ܣ�����ʳ��ˮ��
(3)�������⣬������(SO2C12)�ķе�ϵͣ����ӷ�����Ӧ��������ͨ������ķ������������뿪���ʴ�Ϊ������
(4)���Ʊ��������漰�������������������Ⱦ���������ʣ�����������(SO2C12)�ڿ�������ˮ�����������ҵ�ˮ�ⷴӦ�����ͼ��װ��C��������δ��Ӧ�������Ͷ�������ͬʱ���Է�ֹ�����е�ˮ������������ƿ���ʴ�Ϊ������δ��Ӧ�������Ͷ�������ֹ�����е�ˮ������������ƿ��
(5)Ϊ�����ʵ��IJ��ʣ�����ͨ�������������ʣ��������˿죻����SO2(g) + Cl2(g) ![]() SO2Cl2(l) ��H=-197.3 kJ��mol-1��������ƿ���¶Ƚϸߣ����ʵ����£�����������������(SO2C12) ���ʴ�Ϊ�������������ʣ��������˿죻������ƿ���¶Ƚϸߣ����ʵ����£�
SO2Cl2(l) ��H=-197.3 kJ��mol-1��������ƿ���¶Ƚϸߣ����ʵ����£�����������������(SO2C12) ���ʴ�Ϊ�������������ʣ��������˿죻������ƿ���¶Ƚϸߣ����ʵ����£�
(6) �Ȼ�����(SOC12)�ڿ�������ˮ�����������ҷ�Ӧ�������������������Ȼ�����(SOCl2)��ˮ��Ӧ�Ļ�ѧ����ʽΪSOCl2+H2O=SO2��+2HCl�����Ȼ����ܹ�ˮ�����ɻӷ��Ե��Ȼ��⣬����A1C13��Һ���ܵõ���ˮAlCl3��������SOC12��AlCl3 6H2O�Ļ�ϼ��ȣ��ɵõ���ˮA1C13������ΪSOCl2��AlCl3��6H2O�еĽᾧˮ���ã�������ˮAlCl3��SO2��HCl���壬����SO2��HCl����AlCl3ˮ�⣬�ʴ�Ϊ��SOCl2+H2O=SO2��+2HCl�� (9). SOCl2��AlCl3��6H2O�еĽᾧˮ���ã�������ˮAlCl3��SO2��HCl���壬����SO2��HCl����AlCl3ˮ�⡣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤��������������������ȷ���ǣ� ��
A.���³�ѹ�£�11.2L����������ԭ����ΪNA
B.1.8g��NH4+�����к��еĵ�����Ϊ10NA
C.���³�ѹ�£�48g O3���е���ԭ����Ϊ3NA
D.2.4 g����þ��Ϊþ����ʱʧȥ�ĵ�����Ϊ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����Ԫ�صİ뾶Ϊ��
ԭ�� | N | S | O | Si |
�뾶r/0-10m | 0.75 | 1.02 | 0.74 | 1.17 |
�����������ݣ���ԭ�ӵİ뾶������
A. 0.80��10-10mB. 1.10��10-10mC. 1.20��10-10mD. 0.70��10-10m
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����X��Y��Z����Ԫ�أ���֪��X��Y��Z�ĵ����ڳ����¾�Ϊ���壻��X���ʿ���Z������ȼ�գ�����XZ������Ϊ��ɫ����2molX2���ӿ���1molY2���ӻ�������2molX2Y���ӣ�X2Y�ڳ�����ΪҺ�壻��Z��������X2Y�У�������Һ����Ư�����ã���ϸ��˿����Z2�о���ȼ�գ��Ҳ����غ�ɫ�̣��ƶϣ�
��1��X��Y��Z����Ԫ�ص�����XY �� Z
��2��д���Ģܻ�ѧ��Ӧ����ʽΪ�� ��
�ݵĻ�ѧ��Ӧ����ʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������mgij���壬����˫ԭ�ӷ��ӹ��ɣ�����Ħ������ΪMgmol��1 �� ������٤��������NA��ʾ����
��1������������ԭ������Ϊ����
��2���������ڱ�״���µ����ΪL��
��3���������һ�����ӵ�����Ϊg��
��4������������ˮ���γ�VL��Һ������Һ�����ʵ���Ũ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�����pH��3��ǿ����Һ��������Һ�ֱ��������þ��ȫ��Ӧ������˵����ȷ����
A. ������Һ�����϶������
B. ǿ����Һ�����϶������
C. ���߲�������������
D. ���Ƚ����߲�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˹�Ų��ɺ��о����Ͽ���������������˹����Ī������ʵ���Һ������ϳ��˷����������W(293116Lv)���ú��ص�������Ϊ
A. 116 B. 293 C. 409 D. 177
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���ͼ��ʾ��10mLpH=3��A��Һ�м�ˮϡ�͵�V1mL��ҺpH�ı仯������˵������ȷ����

A. ��V1=100����ϡ��ǰA��Ũ��һ����0.001mol/L
B. a��ˮ�ĵ���̶�һ��С��b��
C. ��AΪNH4Cl��HCl�Ļ����Һ����V1һ������100
D. ��AΪNH4Cl��NH3��H2O�Ļ����Һ������Һ��c(NH4+)>c(Cl-)>c(H+)>c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Կ��淴Ӧ4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)������������ȷ����
4NO(g)+6H2O(g)������������ȷ����
A. ����λʱ��������xmolNO��ͬʱ������xmolNH3����Ӧ�ﵽƽ��״̬
B. �ﵽ��ѧƽ��ʱ4v��(O2)=5v��(NO)
C. �ﵽ��ѧƽ��ʱ�������������ݻ���������Ӧ���ʼ�С���淴Ӧ��������
D. ��ѧ��Ӧ���ʹ�ϵ��2v��(NH3)=3v��(H2O)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com