
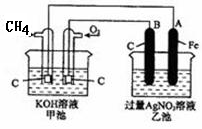
| A.通入O2的电极的电极反应式为:O2 + 2H2O + 4e-= 4OH- |
| B.反应一段时间后,甲池中溶液的pH降低 |
| C.乙池中电极B上发生还原反应 |
| D.当乙池中的某一电极质量增加 10.80g时, 理论上甲池中消耗的气体至少为840mL(标准状况下) |


科目:高中化学 来源:不详 题型:单选题

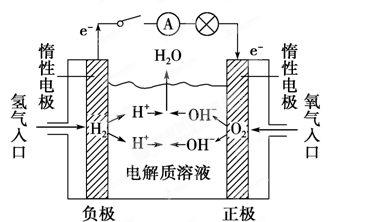
| A.I2在石墨上被还原 |
| B.石墨电极为负极,银电极为正极 |
| C.Ag+从负极向正极移动 |
| D.银电极的电极反应是:Ag - e— =Ag+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
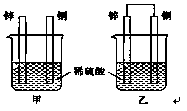
| A.装置甲、乙中铜片表面均无气泡产生 |
| B.装置甲、乙中稀硫酸的浓度均减小 |
| C.装置乙中锌片是正极,铜片是负极 |
| D.装置乙中产生气泡的速率比装置甲快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.锌锰干电池是一种常用的二次电池 |
| B.氢氧燃料电池比火力发电的能量转变率要高 |
| C.锌锰干电池工作一段时间后锌外壳逐渐变薄 |
| D.碱性燃料电池正极反应是O2 + 2H2O + 4e- =4OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

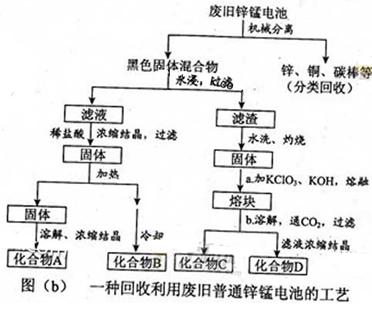
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
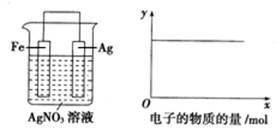
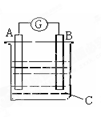
| A.c(Ag+) | B.c(NO3?) | C.Ag棒的质量 | D.溶液的质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com