
| A、① | B、② | C、②③ | D、②③④ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
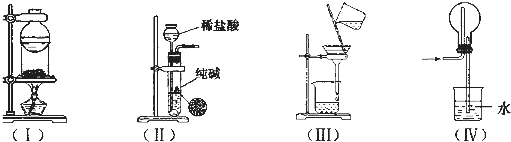
| A、装置(I)用于I2与NH4Cl混合物的分离 |
| B、装置(Ⅱ)用于制取少量纯净的CO2气体 |
| C、装置(Ⅲ)用于去除Fe(0H)3胶体中含有的可溶性物质 |
| D、装置(Ⅳ)用于HC1的吸收,以防倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体 |
| B、在某试样中加入NaOH溶液加热,产生能使蓝色石蕊试纸变红的气体即证明有NH4+ |
| C、焰色反应实验中用硫酸清洗铁丝,灼烧后再沾取试样在酒精灯上灼烧观察 |
| D、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、四种毒品中都含有苯环,都属于芳香烃 |
| B、摇头丸经过消去反应、加成反应可制取冰毒 |
| C、用酸性高锰酸钾溶液可以鉴别大麻和摇头丸 |
| D、氯胺酮分子中环上所有碳原子可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
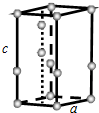
查看答案和解析>>
科目:高中化学 来源: 题型:
| 硫酸 化学纯(CP)(500mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84g?cm-3 质量分数:98% |

查看答案和解析>>
科目:高中化学 来源: 题型:
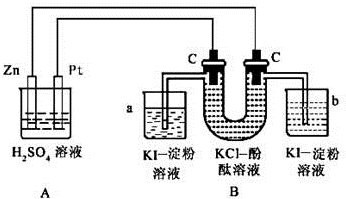
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com