
【题目】某化学兴趣小组利用如图所示装置对SO2的性质进行实验研究。
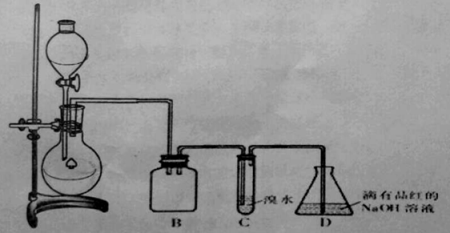
请回答下列问题:
(1)装置B的作用是 。
(2)装置C的目的是检验SO2 性。装置D中NaOH全部转化为NaHSO3的标志是 。
(3)向装置D所得NaHSO3溶液中加入漂白粉,有三种可能的情况:
I.HSO3-与ClO-刚好反应完 II.漂白粉不足 III.漂白粉过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定属于哪一种情况,请完成下表。
(已知酸性:H2SO4>H2CO3>HClO)
实验序号 | 实验操作 | 现象 | 可能的情况 |
① | 滴加少量淀粉-KI溶液,振荡 | III | |
② | 滴加少量溴水,振荡 | II | |
③ | 滴加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
④ | 加入几小块CaCO3固体 | 有气泡产生 |
(4)该小组同学认为,SO2通入含有BaCl2的双氧水中会出现白色沉淀,该反应的离子方程式为 。
【答案】
(1)防止倒吸
(2)还原 品红褪色
(3)①溶液变蓝 ②溴水褪色 ③I ④I或II
(4)SO2+Ba2++H2O2=BaSO4↓+2H+
【解析】
试题分析:该装置的目的是制取SO2并研究其性质。由此可知第一部分为SO2的发生装置,将产生的SO2通入溴水中可验证SO2的还原性,但由于SO2易溶于水,故需考虑防倒吸。据此分析,可知:
(1)装置B起安全瓶的作用,防倒吸。
(2)装置C的目的是检验SO2还原性。装置D中NaOH可用于验证SO2酸性氧化物的性质,当NaOH全部转化为NaHSO3时,此时继续通入的SO2能使品红褪色。
(3)装置D所得NaHSO3溶液中加入漂白粉,发生的反应为HSO3- +ClO- = SO42- + Cl- + H+ ,Ca2+ + SO42- = CaSO4↓。①当漂白粉过量时,滴加少量淀粉-KI溶液,振荡,漂白粉能将I-氧化为I2,I2遇淀粉溶液变蓝;②当漂白粉不足时,原溶液中还存在过滤的NaHSO3溶液,滴加少量溴水,振荡,溴水被还原,表现为溴水褪色;③滴加少量酸性KMnO4溶液,振荡,溶液呈紫色,说明酸性KMnO4溶液未参与反应,即原NaHSO3溶液与漂白粉刚好反应完;④加入几小块CaCO3固体,有气泡产生,说明溶液中有H+剩余,根据上述分析,无论是I或II,溶液都呈酸性。
(4)双氧水将SO2氧化为SO42-,SO42-与BaCl2反应产生白色沉淀,即:SO2+Ba2++H2O2=BaSO4↓+2H+。


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种α- 氨基酸X (CxHyOzNp)的分子组成。取3.34 g X放在纯氧中充分燃烧,生成CO2、H2O和N2。现用下图所示装置进行实验(铁架台、铁夹、酒精灯等未画出),请回答有关问题:
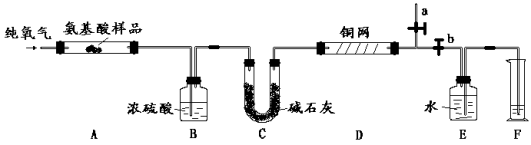
(1)实验开始时,首先打开止水夹a,关闭止水夹b,通一段时间的纯氧气,这样做的目的是 ;之后则需关闭止水夹a,打开止水夹b。
(2)上述装置中A、D处都需要用酒精灯加热,操作时应先点燃 处的酒精灯。
(3)装置D的作用是 。
(4)实验结果:
①B中浓硫酸增重1.62 g,C中碱石灰增重7.04 g,F中收集到224 mL气体(标准状况)。
②X的相对分子质量为167,它是通过 测定的(填一种现代化学仪器)
试通过计算确定该有机物X的分子式(写出计算过程)。
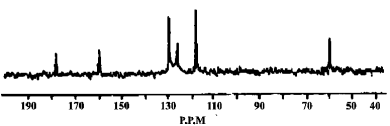
(5)另取3.34 g X与0.2 mol/L 的NaOH溶液反应,最多能中和NaOH溶液200 mL,有机物X的13C-NMR(即核磁共振碳谱,其作用与核磁共振氢谱类似)如下图所示。试确定有机物X的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气中(主要含SO2、CO2)的SO2形成酸雨、污染大气,对烟气进行脱硫,回答下列问题:
(1)采用Ca(ClO)2烟气脱硫可得到较好的效果。已知下列反应:
①SO2(g)+2OH (aq) =SO32 (aq)+H2O(l) ΔH1
②ClO (aq)+SO32 (aq) =SO42 (aq)+Cl (aq) ΔH2
③CaSO4(s) =Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) = CaSO4(s) +H2O(l) +Cl (aq)的ΔH=_ 。
(2)采用氨水烟气脱硫,最终可得到氮肥。将相同物质的量的SO2与NH3溶于水所得溶液中c(H+)﹣c(OH-)= (填字母编号).
A.c(SO32-)﹣c(H2SO3)
B.c(SO32-)+c(NH3·H2O)﹣c(H2SO3)
C.c(HSO3-)+c(SO32-)﹣c(NH4+)
D.c(HSO3-)+2c(SO32-)﹣c(NH4+)
(3)烟气在较高温度经下图方法脱除SO2,并制得H2SO4。
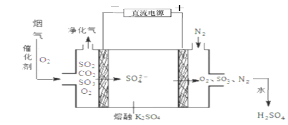
①在阴极放电的物质是 。
②在阳极生成SO3的电极反应式是 。
③已知室温下,Ksp(BaSO4)=1.1×10-10。将脱除SO2后制得的H2SO4配成pH=4 的H2SO4溶液,与pH=9的 Ba(OH)2 溶液混合,若所得混合溶液的 pH=7,则 Ba(OH)2 溶液与 H2SO4 溶液的体积比为 。欲使溶液中c(SO42-) =2.0×10-4mol·L-1,则应保持溶液中 c(Ba2+) = mol·L-1。
(4)一定条件下,用Fe2O3、NiO或Cr2O3作催化剂,利用如下反应回收燃煤烟气中的硫。反应为:2CO(g)+SO2(g)![]() 2CO2(g)+S(l) ΔH= - 270KJ·mol-1其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图1,不考虑催化剂的价格因素,选择_ 为该反应的催化剂较为合理(选填序号)。
2CO2(g)+S(l) ΔH= - 270KJ·mol-1其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图1,不考虑催化剂的价格因素,选择_ 为该反应的催化剂较为合理(选填序号)。

a. Cr2O3 b. NiO c. Fe2O3
选择该催化剂的理由是:_ 。
某科研小组用选择的催化剂,在380℃时,研究了n(CO) : n(SO2)分别为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符合的是
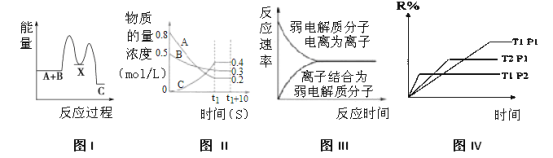
A.反应A+B→C(ΔH<0)分两步进行:①A+B→X(ΔH>0),②X→C(ΔH<0),图I表示总反应过程中能量变化
B.图 II表示反应的化学方程式为3A+B=2C
C.图III表示弱电解质在水中建立电离平衡的过程
D.图IV表示反应M(g)+N(g) R(g)+2L(?)是放热反应且L是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A.氯气溶于水:Cl2+H2O=2H++ Cl-+ClO-
B.用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+=I2+2H2O
C.碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-=CO32-+H2O
D.炭和浓硝酸反应:C+4H++2NO3-=CO2↑+2NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5月20日,国家级风景区太姥山出现大雾天气,能见度不到10米,致使汽车行驶受阻,下列关于雾的说法正确的是( )
A.雾中水滴的直径小于1nm
B.雾中水滴的直径在1nm~100nm间
C.不会产生丁达尔现象
D.无法确定雾中水滴的直径大小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应A(g) + 3B(g)![]() 2C(g)达到平衡的标志是
2C(g)达到平衡的标志是
A.容器内的压强不随时间变化
B.A、B、C的浓度不再变化
C.单位时间内生成n mol A,同时消耗2n mol C
D.A、B、C的分子数之比为1︰3︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学学习了化学反应速率后,联想到曾用H2O2制备氧气,于是设计了下面的实验方案并进行实验探究。
实验编号 | 反 应 物 | 催 化 剂 |
甲 | 试管中加入3 mL 2﹪ H2O2溶液和3滴蒸馏水 | 无 |
乙 | 试管中加入3 mL 5﹪ H2O2溶液和3滴蒸馏水 | 无 |
丙 | 试管中加入3 mL 5﹪ H2O2溶液和3滴蒸馏水 | 1 mL 0.1 mol/L FeCl3溶液 |
丁 | 试管中加入3 mL 5﹪ H2O2溶液和3滴稀盐酸溶液 | 1 mL 0.1 mol/L FeCl3溶液 |
戊 | 试管中加入3 mL 5﹪ H2O2溶液和3滴NaOH溶液 | 1 mL 0.1 mol/L FeCl3溶液 |
【查阅资料】过氧化氢(H2O2),其水溶液俗称双氧水,常温下是一种无色液体,性质比较稳定。在加热的条件下,它能分解生成氧气。研究表明,将新制的5﹪的H2O2溶液加热到65℃时就有氧气放出,加热到80℃时就有较多氧气产生。
(1)上述实验发生反应的化学方程式为 。
(2)实验甲和实验乙的实验目的是 ;
实验丙、实验丁和实验戊的实验目的是 。
(3)请根据该同学查阅的资料分析H2O2的性质,解释实验甲和实验乙能否达到实验目的? 。
(4)实验过程中该同学对实验丙、丁、戊中产生的气体进行收集,并在2分钟内6个时间点对注射器内气体进行读数,记录数据如下表。
时间/s | 20 | 40 | 60 | 80 | 100 | 120 | |
气体体积/mL | 实验丙 | 9.5 | 19.5 | 29.0 | 36.5 | 46.0 | 54.5 |
实验丁 | 8.0 | 16.0 | 23.5 | 31.5 | 39.0 | 46.5 | |
实验戊 | 15.5 | 30.0 | 44.5 | 58.5 | 71.5 | 83.0 | |
①对实验戊,0~20 s的反应速率v1= mL/s,100~120 s的反应速率v2= mL/s。
不考虑实验测量误差,二者速率存在差异的主要原因是 。
②如右图是根据实验收集到最大体积的气体时所用时间绘制的图像。曲线c表示的是实验 (填“丙”、“丁”或“戊”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A.CO2和H2O B.CCl4和KCl C.NaCl和HCl D.SO2和SiO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com