
【题目】下列变化不是由加成反应引起的是( )
A.苯中加溴水振荡,溴水层褪色
B.乙烯通入溴水,溴水褪色
C.石油裂解后的气体通入溴水,溴水褪色
D.苯转化为环己烷
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法正确的是( )
①除去乙烷中少量的乙烯:催化剂条件下通入H2
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏。
A.①② B.②④ C.③④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2=Na2S2O5
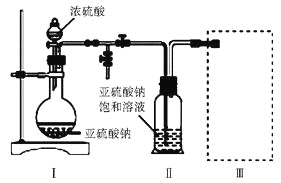
(1)装置Ⅰ中产生气体的化学方程式为____________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是____________。
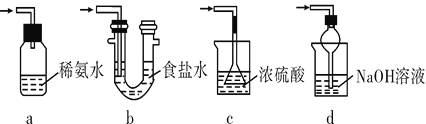
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为______(填字母)。
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO![]() 的电离程度大于水解程度,可采用的实验方法是________(填字母)。
的电离程度大于水解程度,可采用的实验方法是________(填字母)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验,是检验__________的存在(填离子符号)。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)

①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为____________g·L-1。
②在上述实验过程中,若有部分HI被空气中氧化氧化,则测得结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 配置一定物质的量浓度的溶液时,需要用到玻璃棒、胶头滴管
B. 用湿润的pH试纸测量稀氢氧化钠溶液的pH,测量值偏大
C. 可用焰色反应鉴别氯化钠和碳酸钠
D. 用分液的方法从含有少量氯化钠的硝酸钾溶液中提取硝酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别是氢氧化钙溶液、硝酸钾溶液、碳酸钠溶液、盐酸中的一种.已知甲和丙可以反应,甲和丁也可以反应,则下列说法正确的是( )
A. 甲一定是氢氧化钙溶液 B. 丁只能是盐酸
C. 丙不可能是碳酸钠溶液 D. 乙一定是硝酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(11分)请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497 kJ·mol-1.N2(g)+O2(g)=2NO(g)△H=+180.0kJ·mol-1。则相同条件下破坏化学键需要吸收的能量为_______kJ。
(2)25℃时,pH=5的CH3COOH溶液中.由水电离出的氢离子浓度c(H+)=________ kJ·mol-1;往溶液中加入少量NaOH固体,则溶液中![]() _______(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:_______。
_______(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:_______。
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其中含碳元素的各种微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。

①在同一溶液中,H2CO3、HCO3-、CO32-______(填“能”或“不能”)大量共存。
②当pH =7时,溶液中含碳元素的微粒主要为________。溶液中各种离子的物质的量浓度大小关系为______________。
③反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=______________________。
HCO3-+OH-的平衡常数Kh=______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用和相应的原理(用化学方程式表示)及基本反应类型不正确的是( )
A.酒精做燃料:C2H5OH+3O2![]() 2CO2+3H2O 氧化反应
2CO2+3H2O 氧化反应
B.电解水制取氢气:2H2O![]() 2H2↑+O2↑ 分解反应
2H2↑+O2↑ 分解反应
C.敞口放置的氢氧化钠固体变质:2NaOH+CO2=Na2CO3+H2O 复分解反应
D.比较铜和银的活动性:Cu+2AgNO3=Cu(NO3)2+2Ag 置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁常用作催熟剂、除草剂等,实验室制备Mg(ClO3)2·6H2O的流程如下:
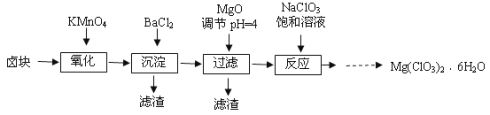
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
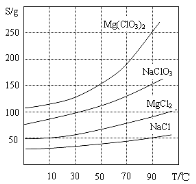
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
(1)过滤所需要的主要玻璃仪器有 。
(2)加MgO后过滤所得滤渣的主要成分的化学式为 。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为 ,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:
①蒸发结晶;② ;洗涤;
③将滤液冷却结晶;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:(已知Mg(ClO3)2·6H2O的摩尔质量为299 g/mol)
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20 .00 mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7 溶液滴定剩余的Fe2+至终点。反应的方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7 溶液15.00 mL。
① 写出步骤2中发生反应的离子方程式 ;
② 产品中Mg(ClO3)2·6H2O的质量分数为 。(保留到小数点后一位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com