
分析 (1)二氧化硫和氧气反应方程式为2SO2(g)+O2(g)?2SO3(g),开始时没有SO3,根据方程式知,反应c(SO2)(消耗)=c(SO3)(生成)=bmol/L,则SO2 起始物质的量浓度=c(SO2)(消耗)+c(SO2)(剩余)=生成v(SO3)=$\frac{△c}{△t}$;
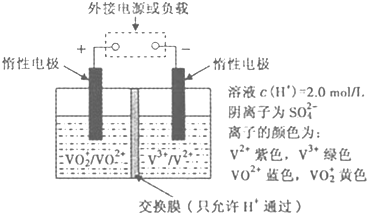
(2)①左槽溶液逐渐由黄变蓝,VO2+转变为VO2+,发生还原反应,应为原电池的正极,
②充电过程中,右槽连接电源的负极,发生还原反应,为电解池的阴极,电极反应式为V3++e-=V2+,
③充电时,左槽发生的反应为VO2++H2O-e-=VO2++2H+当转移电子为3.01×1023个即为0.5 mol电子时,生成氢离子为0.5 mol.
解答 解:(1)二氧化硫和氧气反应方程式为2SO2(g)+O2(g)?2SO3(g),开始时没有SO3,根据方程式知,反应c(SO2)(消耗)=c(SO3)(生成)=bmol/L,则SO2 起始物质的量浓度=c(SO2)(消耗)+c(SO2)(剩余)=bmol/L+amol/L=(a+b)mol/L;
生成v(SO3)=$\frac{△c}{△t}$=$\frac{bmol/L}{tmin}$=$\frac{b}{t}$mol/L,
故答案为:a+b;$\frac{b}{t}$;
(2)①当左槽溶液逐渐由黄变蓝,其电极反应式为VO2++2H++e-=VO2++H2O,说明此时为原电池,且为原电池的正极,故答案为:VO2++2H++e-=VO2++H2O;
②充电过程中,右槽连接的是电源负极,为电解池的阴极,电极反应式为V3++e-=V2+,V3+为绿色,V2+为紫色,
故可以看到右槽溶液颜色逐渐由绿色变为紫色.
故答案为:绿;紫;
③放电过程中,电极反应式为VO2++2H++e-=VO2++H2O,氢离子的作用是充电时,参与正极反应,通过交换膜定向移动使溶液成电中性;左槽发生的反应为VO2++H2O=VO2++2H++e-,当转移电子为3.01×1023个即为0.5 mol电子时,生成氢离子为0.5mol;氢离子变化0.5mol;
故答案为:参与正极反应;通过交换膜定向移动使溶液成电中性;0.5mol.
点评 本题考查化学平衡计算、原电池和电解池原理,为高频考点,侧重考查学生分析判断能力,难点是电极反应式的书写,注意结合电解质溶液酸碱性书写,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 向碳酸氢钙溶液中加过量氢氧化钠Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合Ba2++OH-+HCO3-═BaCO3↓+H2O | |
| C. | 氯化铝与过量氨水反应 Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 过量CO2通入氢氧化钡的稀溶液中 CO2+OH-═HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
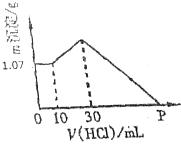 把NaOH、AlCl3、FeCl3三种固体组成的混合物熔于足量水中后,有1.07g沉淀,在所得溶液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示,试求
把NaOH、AlCl3、FeCl3三种固体组成的混合物熔于足量水中后,有1.07g沉淀,在所得溶液中逐滴加入0.5mol/L盐酸,加入盐酸体积与生成沉淀的质量关系如图所示,试求查看答案和解析>>
科目:高中化学 来源: 题型:解答题
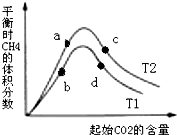 有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品.其构想分成3个步骤:
有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品.其构想分成3个步骤:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用物质A表示的反应的平均速率为 0.6 mol•L-1•s-1 | |
| B. | 用物质B表示的反应的平均速率为 0.6 mol•L-1•s-1 | |
| C. | 2 s 时物质A的转化率为70% | |
| D. | 2 s 时物质B的浓度为 0.7 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用布朗运动可区别溶液和胶体 | |
| B. | 溶液中通过一束光线时没有明显现象,胶体中通过一束光线时出现明显的光路 | |
| C. | 胶体微粒带电荷,溶液中溶质微粒不带电荷 | |
| D. | 制备Fe(OH)3胶体的方法是:将饱和FeCl3溶液通入热的NaOH溶液中并持续煮沸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
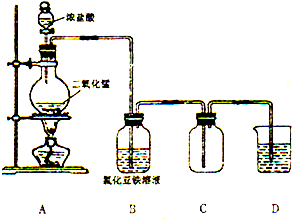 某化学研究型学习小组利用以下装置制取并探究氯气的性质.【装置A中发生反应的化学方程式:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O】
某化学研究型学习小组利用以下装置制取并探究氯气的性质.【装置A中发生反应的化学方程式:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O】查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com