
【题目】某物质的焰色反应呈黄色,下列判断正确的是( )
A.该物质一定是金属钠B.该物质一定是钠盐
C.该物质一定含有钠元素D.该物质一定不含有钾元素
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,2.24LHF所含分子数为0.1NA
B. 某温度下,2LpH=12的NaOH溶液中含OH-的数目为0.02NA
C. 丙烯和环丙烷组成的42g混合气体分子中共用电子对总数为9NA
D. 化学反应中每生成1molO2,转移的电子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修5:有机化学基础]光刻胶的一种合成路线如图:
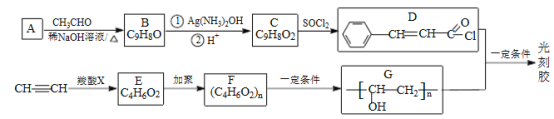
已知:
I. 
Ⅱ. ![]()
Ⅲ.RCOOH+CH≡CH→RCOOCH=CH2
Ⅳ.羧基和酯基不能与氢气发生加成反应。
回答下列问题:
(1)A的名称是_____,C 中所含官能团的名称是__________。
(2)由C生成D、乙炔生成E的反应类型分别为_____ 、_____ 。
(3)E的结构简式为_____ 。
(4)D+G→光刻胶的化学方程式为__________。
(5)T是C的同分异构体,T 具有下列性质或特征: ①能发生水解反应和银镜反应;②能使溴水褪色;③属于芳香族化合物。其中核磁共振氢谱为5组峰,且峰面积比为1:1:2:2:2的结构简式为_____________。
(6)写出用乙醛和丙炔为原料制备化合物CH3CH2CH2COOCH2CH2CH3的合成路线__________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)
后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为_____mol·L-1。
(2)取用任意体积的该盐溶液时,下列物理量中会随所取体积的多少而变化的是________(填字母)。
A.溶液中NaClO的物质的量 B.溶液的浓度
C.溶液中NaClO的摩尔质量 D.溶液的密度
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。回答下列问题。
①如图所示的仪器中,有些是不需要,配制上述溶液还需要_____________玻璃仪器

②需要称量NaClO固体的质量为_______ g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制200 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为________ mol·L-1。
②需用浓硫酸的体积为________ mL。
③若所配制的稀硫酸浓度偏小,则下列可能的原因分析中正确的是_______。
A.配制前,容量瓶中有少量蒸馏水 B.量取浓硫酸时,仰视液体的凹液面
C.未冷却,立即转移至容量瓶定容 D.定容时,仰视溶液的凹液面
查看答案和解析>>
科目:高中化学 来源: 题型:
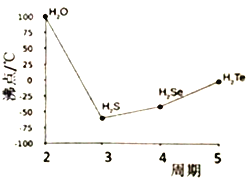
【题目】硫、钴及其相关化合物用途非常广泛。回答下列问题:
(1)基态Co原子价电子轨道排布式为________,第四电离能I4(Co)<I4(Fe),其原因是_______;Co与Ca同周期且最外层电子数相同,单质钴的熔沸点均比钙大,其原因是_______.
(2)单质硫与熟石灰加热产物之一为CaS3,S32-的几何形状是_______,中心原子杂化方式是_______,与其互为等电子体的分子是_______ (举1例)。
(3)K和Na位于同主族,K2S的熔点为840℃,Na2S的熔点为950℃,前者熔点较低的原因是_______ 。
(4)S与O、Se、Te位于同一主族,它们的氢化物的沸点如右图所示,沸点按图像所示变为的原因是_______ 。
(5)钴的一种化合物晶胞结构如下图所示。

①已知A点的原子坐标参数为为(0,0,0),B点为(![]() ,0,
,0,![]() ),则C点的原子坐标参数为_____。
),则C点的原子坐标参数为_____。
②已知晶胞参数为a=0.5485nm,则该晶体的密度为_____g/cm3(列出计算表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中的物质绝大多数以混合物的形式存在,为了便于研究和利用,常需对混合物进行分离和提纯。下列A、B、C、D是中学常见的混合物分离或提纯的装置。
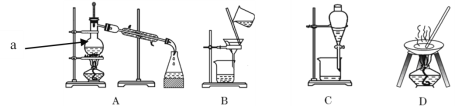
I.请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D 填入适当的空格中。
(1)碳酸钙悬浊液中分离出碳酸钙___________;
(2)氯化钠溶液中分离出氯化钠___________;
(3)分离植物油和水___________;
(4)海水淡化___________;
(5)氯化钠溶液中分离出水___________;
(6)除去自来水中的Cl﹣等杂质___________;
(7)从碘水中分离出I2___________。
II.碘水中提取碘单质的方法如下:
(1)萃取分液
①下列可作为碘水中提取碘单质萃取剂的是___________
A.酒精 B.苯
②分液漏斗在使用前必须先___________
③查资料得知:ρ(H2O)>ρ(苯)>ρ(酒精),若用①中所选萃取剂萃取碘水中的碘单质,分液时,水层应由分液漏斗的______端口放出,有机层应由分液漏斗的______端口放出(此问填“上”或者“下”)
(2)蒸馏
①装置A中a的名称是_______,冷凝装置中冷凝水应该________口进(填“上”或“下”),
这样做的目的是________________________,装置C在分液时为使液体顺利滴下,除打开漏斗下端的旋塞外,还应进行的具体操作是__________________________。
②已知碘和四氯化碳的熔沸点数据如下表
熔点 | 沸点 | |
碘 | 113.7℃ | 184.3℃ |
四氯化碳 | -22.6℃ | 76.8℃ |
若用蒸馏法分离碘和四氯化碳的混合物,锥形瓶中先收集到的物质的名称是___________。
Ⅲ. 海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:
[海水]![]() [粗盐]
[粗盐]![]() [食盐水]→[氯化钠晶体]
[食盐水]→[氯化钠晶体]
问题一:粗盐中含Ca2+、Mg2+、SO42﹣等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④调节溶液的pH等于7 ⑤溶解 ⑥过滤 ⑦蒸发正确的操作顺序是__________(填选项字母).
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
问题二:由海水到氯化钠晶体的实验过程中要用到的主要装置是_________________(从给定的四种装置中选择,填字母)。
问题三:粗盐中含有少量泥沙、CaCl2、MgCl2及硫酸盐,将粗盐溶解后,先过滤将泥沙除去,再检验滤液中的SO42﹣,检验滤液中的SO42﹣的实验操作和现象是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 阿伏加德罗常数是12g碳中所含有的碳原子数
B. 已知微粒个数,可通过阿伏加德罗常数计算出微粒的物质的量
C. 阿伏加德罗常数的数值是6.02×1023
D. 阿伏加德罗常数的符号为NA,通常用6.02×1023表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔质量是 ______ 的物质所具有的质量![]() 符号: ______
符号: ______ ![]() 单位: ______ 或 ______ .
单位: ______ 或 ______ .
A. 单位物质的量;M;![]() ;
;![]()
B. 物质的量;m;![]() ;
;![]()
C. 单位物质的量;m;g;![]()
D. 物质的量;M;![]() ;kg
;kg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲除去甲烷中混有的乙烯,得到纯净的甲烷,最好依次通过( )
A.溴水,烧碱溶液,浓H2SO4
B.酸性KMnO4溶液,浓H2SO4
C.澄清石灰水,浓H2SO4
D.浓H2SO4 , 酸性KMnO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com