
| A、电解前电解质溶液的浓度为0.2mol/L(假设溶液体积不变) |
B、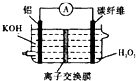 若用Al--H2O2电池(如图)为电解的电源,则理论上应消耗Al的质量为2.7g |
| C、若向电解后溶液中加入Fe和Fe2O3的混合物至恰好完全溶解,得到标况下0.896LNO气体,所得溶液中加KSCN溶液,无血色出现,则溶液的混合物中含铁元素的质量为4.48g |
| D、阳极产生O2在标况下体积为2.24L |
| n |
| V |


科目:高中化学 来源: 题型:
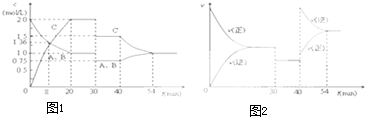
| A、第8min时 A的反应速率为0.08mol?L-1?min-1 |
| B、在0-54分钟的反应过程中该可逆反应的平衡常数始终为4 |
| C、30min时改变的条件是降低温度,40min时改变的条件是升高温度 |
| D、反应方程式中的x=1,且正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2、O3 |
| B、H2SO4、H2CO3 |
| C、SO2、NO |
| D、Na2SO3、KClO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
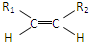
| ①O3 |
| ②Zn,H2O |
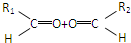
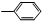 ③-CH═CH2
③-CH═CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
 为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 26.22 | 25.35 | 25.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| +水 |
| 消去 |
| 催化氧化 |
| A、A是乙炔,B是乙醇 |
| B、A是乙烯,C是乙醛 |
| C、A是乙烯,C是乙醇 |
| D、A是环己烷,C是苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组别 | ① | ② | ③ | ④ | ⑤ |
| 加入样品的质量/g | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 |
| 加入0.2mol/L稀盐酸的体积/mL | 20.0 | 40.0 | 60.0 | 80.0 | 100.0 |
| 充分反应后生成标准状况下气体的体积/mL | 44.8 | 89.6 | 134.4 | 179.2 | 179.2 |
| A、20% | B、40% |
| C、60% | D、80% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com