
��������ȷ��ʾ��Ӧ���̵����ӷ���ʽ���ǣ� ��
A�������Լ��Ե�ԭ��CO32��+ 2 H2O = H2CO3 + 2 OH��
B��ϡ�����ϡ����������Һ��Ӧ���к��ȡ�H=��57.3 kJ/mol����ϡ������ϡ����������Һ������Ӧ���Ȼ�ѧ����ʽ��ʾΪ��
 H2SO4(l)+ KOH(l) =
H2SO4(l)+ KOH(l) =  K2SO4
(l)+ H2O(l) ��H=��57.3 kJ/mol
K2SO4
(l)+ H2O(l) ��H=��57.3 kJ/mol
C��������Һ�еμ�����������Һ�����������ʵ������
2 Al3+ +3 SO42��+3 Ba2+ +6 OH�� = 2 Al(OH)3 ��+ 3 BaSO4 ��
D��ͭ��Ũ�����ϼ��ȣ�2H2SO4��Ũ��+Cu SO2��+Cu2+ +SO42��+2 H2O
SO2��+Cu2+ +SO42��+2 H2O
C
��������
���������A�������Լ��Ե�ԭ��CO32��+ H2O = HCO3�� + OH��������B��ϡ�����ϡ����������Һ��Ӧ���к��ȡ�H=��57.3 kJ/mol����ϡ������ϡ����������Һ������Ӧ���Ȼ�ѧ����ʽ��ʾΪ��
 H2SO4(aq)+ KOH(aq) =
H2SO4(aq)+ KOH(aq) = 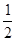 K2SO4
(aq)+ H2O(l) ��H=��57.3 kJ/mol������C����ȷ��D��ͭ��Ũ�����ϼ��ȣ����ɵ�����ͭ�ǰ�ɫ�ģ�ԭ����ˮ̫�٣�û�е��������״̬��
K2SO4
(aq)+ H2O(l) ��H=��57.3 kJ/mol������C����ȷ��D��ͭ��Ũ�����ϼ��ȣ����ɵ�����ͭ�ǰ�ɫ�ģ�ԭ����ˮ̫�٣�û�е��������״̬��
2H2SO4��Ũ��+Cu SO2��+CuSO4+2 H2O��
SO2��+CuSO4+2 H2O��
���㣺�������ӷ���ʽ����д��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com