
【题目】向10 mL浓度均为3 mol·L-1的HNO3与H2SO4的混合溶液中加入1.92 g铜,充分反应后,设溶液体积仍为10 mL。求:
(1)产生的气体在标准状况下的体积是多少升?__________
(2)反应后溶液中各溶质的离子浓度是多少?_____________
【答案】 0.448 L Cu2+:3 mol·L-1 H+:1 mol·L-1 NO![]() :1 mol·L-1 SO
:1 mol·L-1 SO![]() :3 mol·L-1
:3 mol·L-1
【解析】溶液中的氢离子既包括硝酸电离的又包括硫酸电离的.所以n(H+)=3mol/L×0.01L×1+3mol/L×0.01L×2=0.09mol,n(NO3-)=3mol/L×0.01L=0.03mol,n(Cu)=1.92g÷64g/mol=0.03mol,则
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3 8 2 3 2
0.03 0.09 0.03
可知Cu完全反应,H+和NO3-过量,则
(1)由反应的离子方程式可知:n(NO)=0.03mol×2/3=0.02mol,V(NO)=0.02mol×22.4L/mol=0.448L;
(2)0.03molCu完全反应,则生成0.03molCu2+,消耗n(H+)=0.03mol×8/3=0.08mol,剩余n(H+)=0.09mol-0.08mol=0.01mol,消耗n(NO3-)=n(NO)=0.02mol,则剩余n(NO3-)=0.03mol-0.02mol=0.01mol,所以反应后溶液中c(Cu2+)=0.03mol÷0.01L=3mol/L,c(H+)=0.01mol÷0.01L=1mol/L,c(NO3-)=0.01mol÷0.01L=1mol/L,由于SO42-没有参加反应,反应后的浓度仍为3mol/L。


科目:高中化学 来源: 题型:
【题目】下列分子的立体构型可用sp2杂化轨道来解释的是( )
①BF3 ②CH3═CH2 ③苯 ④CH≡CH ⑤NH3 ⑥CH4 ⑦HCHO.
A.①②③⑦
B.①⑤⑥
C.②③④⑦
D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液只含Cl![]() 、CO
、CO![]() 、SO
、SO![]() 、Na
、Na![]() 、K
、K![]() 、Mg
、Mg![]() 六种离子中的某几种。经实验:
六种离子中的某几种。经实验:
①原溶液![]() 白色沉淀;
白色沉淀;
②原溶液中加BaCl2溶液不产生沉淀;
③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解。回答下列问题:
(1)试分析原溶液中一定含有的离子是______________,一定不含有的离子是_______,可能含有的离子是______________。
(2)有的同学认为实验③可以省略,你认为是否正确(填“是”或“否”)_________,说明理由_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质露置在空气中易变质的是( )
①漂白粉 ②苯酚 ③水玻璃 ④硫酸钠 ⑤烧碱⑥亚硫酸钠 ⑦胆矾 ⑧硬化油
A.除④⑦⑧外
B.除④⑦外
C.除⑥⑦⑧外
D.全部易变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质分类或归类正确的是( )
①混合物:石炭酸、福尔马林、水玻璃、水银 ②化合物:CaCl2、烧碱、聚苯乙稀、HD ③电解质:明矾、胆矾、冰醋酸、硫酸钡 ④同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2 ⑤同素异形体:C60、C70、金刚石、石墨
A.①③④
B.③⑤
C.②③④
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验Ⅰ:下图1为实验室制取氨的实验装置。

(1)写出A中所发生反应的化学方程式____________________________________。
(2)在收集氨时试管口棉花的作用是______________________________________。
(3)另一学生积极思考产生喷泉的其他方法,设计了图3装置。首先在锥形瓶中分别加入足量的下列物质,反应后产生喷泉的是(____)
A.CaCO3粉末和浓盐酸 B.NH4HCO3溶液与稀NaOH溶液
C.HCl和AgNO3溶液 D.HCl和酚酞溶液
(4)该同学又向锥形瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质可以是(____)
A.硝酸铵 B.食盐 C.浓硫酸
实验Ⅱ:为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
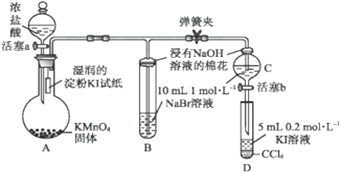
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为橙黄色时,夹紧弹簧夹。
Ⅲ.当B中橙黄色溶液颜色变深时,关闭活塞a。
Ⅳ. 打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡。
(1)A中产生黄绿色气体,其化学方程式是__________________
(2)B中溶液发生反应的离子方程式是____________________
(3)过程Ⅳ的目的为______________________________________
(4)D中出现的现象为____________________________
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下_________,得电子能力逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种短周期元素,其元素特征信息如下:A的单质是密度最小的物质;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子;C的原子最外层电子数是其内层电子数的三倍;D与B同周期,该周期中D的简单离子半径最小;B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分;F元素最高正价与最低负价的代数和为4.
(1)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式 .
(2)D、E、F的简单离子半径由大到小的顺序是(直接用化学式表示) .
(3)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解.向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等.则原混合物中D单质的质量分数为 .
(4)一定量的石灰乳中通入一定量的E单质,两者恰好完全反应,生成物中有三种含E元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.t2时反应的化学方程式为 . 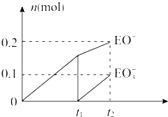
(5)A、B形成的化合物BA在有机合成中用途很广泛.它可以夺取很多化合物中的质子而生成相应的钠的化合物.写出它与乙醇反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,能氧化浓HCl生成Cl2;PbO2不稳定,随温度升高按下列顺序逐步分PbO2→Pb2O3→Pb3O4→PbO.现将a mol PbO2加热分解,收集产生的O2;向加热后所得固体中加入足量的浓盐酸,收集产生的Cl2 . 加热反应后所得固体中,Pb2+占Pb元素的物质的量分数为x;两步反应中收集的O2和Cl2的物质的量之和为y mol.试回答下列问题:
(1)试写出Pb2O3与浓盐酸反应的化学方程式 .
(2)用含x与a的表达式表示产生的O2、Cl2的物质的量n(O2)= , n(Cl2)= .
(3)写出y与a、x的函数关系式: .
(4)若两步反应中O2和Cl2的物质的量之比为5:3,则剩余固体中含有的物质为;其物质的量之比为 .
(5)PbO2和Pb经常作制造蓄电池的原材料,铅蓄电池的工作原理:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O.现有一种生产NH4NO3的新工艺,电解NO制备NH4NO3 , 其工作原理如图所示,为使电解产物全部转化为NH4NO3 , 需补充物质A,A是 , 说明理由: . 生产1吨硝酸铵需消耗Pb的物质的量是kg(保留到整数).
2PbSO4+2H2O.现有一种生产NH4NO3的新工艺,电解NO制备NH4NO3 , 其工作原理如图所示,为使电解产物全部转化为NH4NO3 , 需补充物质A,A是 , 说明理由: . 生产1吨硝酸铵需消耗Pb的物质的量是kg(保留到整数).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com