
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源:2016届安徽省高三上第四次段考化学试卷(解析版) 题型:推断题
X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大。元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-半径,Y的氧化物是形成酸雨的主要物质之一。
请回答:
(1)Q元素在周期表中的位置
(2)将这五种元素原子半径从大到小排列,排在第三的元素原子是 (填元素符号)
(3)元素的非金属性Z Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有 (填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4) X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式 ;B的水溶液不呈中性的原因 (用离子方程式表示)
(5) 液态A类似X2Z能微弱电离且产生电子数相同的两种离子,则液态A的电离方程式为
(6)若使A按下列途径完全转化为F:
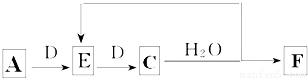
①F的化学式为 ;
②参加反应的A与完全转化为F时整个过程中消耗D的物质的量之比为
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:实验题
过氧化氢的水溶液称为双氧水,常用作消毒剂、杀菌、漂白及工业生产原料等。
某实验小组取一定量的过氧化氢溶液,测定H2O2的含量,并探究H2O2的某些性质、应用。
Ⅰ.测定市售过氧化氢溶液中H2O2的质量分数
(1)量取10.00mL密度为ρ g/mL的市售过氧化氢溶液,应选用仪器是_______(填序号);
A.10mL量筒 B.酸式滴定管 C.碱式滴定管 D.50mL烧杯
(2)将上述溶液稀释至250mL,操作中用到的玻璃仪器是:烧杯、玻璃棒、_________(填名称);
(3)取25.00mL(2)中稀溶液至锥形瓶中,加适量稀硫酸酸化,用c mol/L KMnO4标准液滴定,
①完成反应的离子方程式:____MnO4-+___H2O2+___H+→___Mn2++___H2O+___;
②该小组一共进行了四次测定实验,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
消耗KMnO4溶液体积/mL | 25.00 | 25.02 | 20.00 | 24.98 |
根据所给数据,计算原过氧化氢溶液中H2O2质量分数____________________________。
(4)下列操作会导致测定结果偏高的是_____________。
A.滴定前滴定管尖嘴中有气泡,滴定的气泡消失
B.将H2O2溶液稀释成250.00mL溶液时,定容俯视刻度线
C.终点时,滴入一滴KMnO4溶液,溶液呈红色,向红色溶液返滴一滴H2O2溶液仍呈红色
Ⅱ.探究H2O2的性质
(5)上述测定原理,H2O2体现__________性;
(6)若要验证H2O2不稳定性,操作是____________________________。
Ⅲ.探究H2O2的应用
(7)为研究工业生产流程中双氧水的用量、调节的pH、反应时间三个关键生产条件对产品质量的影响,需要进行七组实验,若实验序号1是该流程的理论最佳生产条件,请在下表中填入实验序号为5、6、7的三组实验条件。
实验序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
双氧水(mL) | 0.5 | 0.4 | 0.6 | 0.5 | |||
pH | 11 | 11 | 11 | 10 | |||
反应时间 | 3 | 3 | 3 | 3 |
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期12月月考化学试卷(解析版) 题型:实验题
某研究小组探究SO2和Fe(NO3)3溶液的反应,其反应装置如图所示:
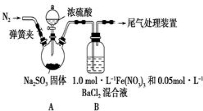
已知:l.0mol·L﹣1的Fe(NO3)3溶液的pH=l,请回答下列问题:
(1)装置A中反应的化学方程式是 。
(2)为排除空气对实验的干扰,滴加浓硫酸之前进行的操作是 。
(3)装置B中产生了白色沉淀,其成分是 , 分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+反应; 猜想2:在酸性条件下SO2与NO3﹣反应; 猜想3:…
(4)甲同学从装置B中取出适量反应后的溶液,能使KMnO4溶液褪色。
【得出结论】:猜想1成立.其结论正确吗? (填“是”或“否”)。若不正确,理由是
(用离子方程式表示)。
(5)乙同学设计实验验证猜想2,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是 (填序号)。
a.0.1mol/L稀硝酸 b.1.5mol/LFe(NO3)2溶液
c.6.0mol/LNaNO3和0.2mol/L盐酸等体积混合的溶液
d.3.0mol/LNaNO3和0.1mol/L硫酸等体积混合的溶液
(6)(4分)在实际操作中,当SO2通入Fe(NO3)3溶液时观察到的现象;溶液由黄色变为浅绿色,接着又变为黄色,请用相关离子方程式表示其过程: 、 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德石门第一中学高一上期中化学试卷(解析版) 题型:选择题
下列叙述中,正确的是( )
A、含金属元素的离子一定是阳离子
B、在氧化还原反应中,非金属单质一定是还原剂
C、某元素从化合态变为游离态时,该元素一定被还原
D、金属阳离子被还原不一定得到金属单质
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期12月月考化学试卷(解析版) 题型:选择题
在AlCl3和FeCl3的混合液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得到的沉淀物是( )
A.Fe2S3、I2 B.Al(OH)3、I2 C.Fe(OH)3、Al(OH)3 D.FeS、S、Al(OH)3
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上学期12月月考理综化学试卷(解析版) 题型:选择题
某溶液中除H+、OH-外,还含有大量的Mg2+、Fe3+、Cl-,且这三种离子物质的量浓度之比为l:l:6。下列有关该溶液的判断正确的是
A.向该溶液中加入KI溶液后,原有的五种离子物质的量不变
B.向该溶液中滴加稀NaOH溶液,立即出现白色沉淀
C.若溶液中c(Cl-)=0.6 mol·L-1,则该溶液的pH为l
D.向该溶液中加入过量铁粉,只发生置换反应
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第三次模拟考试理综化学试卷(解析版) 题型:实验题
某化学兴趣小组的同学为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,他们开展了如下探究性学习。
I.查阅资料,获取了相关知识信息:
金属的活泼性不同,其硝酸盐分解产物不同,依据金属活动顺序表:
(1)K→Na等活泼金属的硝酸盐分解生成亚硝酸盐和氧气,如:2NaNO3 2NaNO2+O2↑;
2NaNO2+O2↑;
(2)Mg→Cu等较活泼金属的硝酸盐分解生成氧化物、NO2和O2,如:2Cu(NO3)2
 2CuO+4NO2↑+O2↑;
2CuO+4NO2↑+O2↑;
(3)Hg以后不活泼金属的硝酸盐分解生成金属、NO2和O2,如:2AgNO3 2Ag+2NO2↑+O2↑.
2Ag+2NO2↑+O2↑.
Ⅱ.实验探究,在实验的基础上得到相关结论:
【实验一】探究Fe(NO3)2热分解固体产物中Fe元素的价态.该小组甲同学将Fe(NO3)2热分解固体产物溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验.
(1)提出猜想:猜想一:Fe元素只显+2价;
猜想二:Fe元素只显+3价;
猜想三:Fe元素既有+2价又有+3价。
(2)实验操作:①向一份溶液中滴入KSCN溶液;②向另一份溶液中滴入___________溶液。
(3)实验现象:实验①_________;实验②溶液不褪色。
(4)实验结论:猜想二成立,Fe(NO3)2分解的化学方程式是______________________。
【实验二】探究Fe(NO3)2热分解气体产物的性质.小组乙、丙同学进行了如图所示的实验(收集时操作恰当,几乎没有空气):

实验步骤:①连接仪器;②检查装置气密性;③取一定质量Fe(NO3)2装于大试管中,并重新连接好仪器;④加热;⑤…
(1)乙同学使用Ⅰ装置收集气体,恰好收集到27mL红棕色气体。
(2)丙同学取等质量的Fe(NO3)2同样条件下热分解,并使用Ⅱ装置收集气体产物,可收集到_____ mL气体。【实验三】探究固体混合物的组成和特征.
(1)小组丁同学取KNO3、Cu(NO3)2、Fe(NO3)2的混合粉末充分加热后用排水法未收集到任何气体,则KNO3、Cu(NO3)2、Fe(NO3)2的物质的量之比可能是________(填字母序号)。
A.1:2:3 B. l:2:2 C.2:1:3 D.3:8:5
(2)若取按上述比例混合的固体硝酸盐1mol溶于200mL 3mol•L-1的硫酸中,再向溶液中加入铜片,可溶解的铜的最大质量为__________g。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西柳州铁路第一中学高二上段考理化学卷(解析版) 题型:选择题
有一种酸式盐AHB,它的水溶液呈弱碱性。则以下说法:
①相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度;
②H2B不是强酸;
③HB-的电离程度大于HB- 的水解程度;
的水解程度;
④该盐溶液的电离方程式一般写成:AHB A++HB-,HB-
A++HB-,HB- H++B2-
H++B2-
其中错误选项的组合是
A.①② B.③④ C.②③ D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com