
 向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应的溶液中:Na+、Mg2+、SO42-、HCO3- | |
| B. | b点对应的溶液中:Ag+、Ca2+、NO3-、F- | |
| C. | c点对应的溶液中:Na+、S2-、SO42-、Cl- | |
| D. | d点对应的溶液中:K+、NH4+、I-、CO32- |
分析 A.a点溶液显碱性,NaOH过量,碳酸氢根离子能够与氢氧根离子反应;
B.c点偏铝酸钠与氯化铝恰好完全反应生成氢氧化铝,溶液中存在氯离子,氯离子与银离子反应生成氯化银沉淀;
C.b点恰好生成偏铝酸钠,四种离子之间不反应,都不与偏铝酸钠反应;
D.d点为氯化铝溶液,碳酸根离子与铝离子发生双水解反应.
解答 解:A.a点溶液显碱性,NaOH过量,HCO3-与氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.c点偏铝酸钠与氯化铝恰好完全反应生成氢氧化铝,还生成氯化钠,则不可能存在Ag+,故B错误;
C.b点恰好生成偏铝酸钠,溶液显碱性,Na+、S2-、SO42-、Cl-离子之间不反应,都不与偏铝酸钠反应,在溶液中能够大量共存,故C正确;
D.d点为氯化铝溶液,Al3+、CO32-相互促进水解生成沉淀和气体,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的正误判断,该题是高考中的高频题,属于中等难度的试题,明确图象中各点对应的反应及溶液的成分、离子之间的反应是解答的关键,注意选项D中的相互促进水解反应.


科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ②③⑥ | C. | ①⑤ | D. | ①④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\stackrel{+4}{Mn}$O2→$\stackrel{+2}{Mn}$SO4 | B. | Al 2O 3→Al(OH) 3 | C. | $\stackrel{-1}{KI}$→K$\stackrel{+5}{I}$O3 | D. | HNO 3→NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
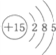 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该原子位于第三周期,ⅤA族 | B. | 该原子位于第五周期,ⅢB族 | ||
| C. | 该原子位于第三周期,ⅤB族 | D. | 该原子位于第五周期,ⅢA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com