
| A. | 1个I-I键断裂的同时,有2个H-I键断裂 | |
| B. | H2、I2、HI的浓度相等 | |
| C. | 混合气体的质量不再改变 | |
| D. | 混合气体密度恒定不变 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、1个I-I键断裂相当于形成2个H-I键,同时有2个H-I键断裂,正逆反应速率相等,故A正确;
B、H2、I2、HI的浓度相等,并不是不变,故B错误;
C、混合气体的质量始终不改变,所以不一定平衡,故C错误;
D、混合气体密度始终不改变,所以不一定平衡,故D错误;
故选A.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等.


 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 高氯酸铵为离子化合物 | |
| B. | 高氯酸铵中只含有离子键 | |
| C. | 高氯酸铵中既有离子键又有共价键,同时还有配位键 | |
| D. | 高氯酸铵中阴、阳离子的个数比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下pH=7的CH3COOH与CH3COONa的混合液中离子的浓度大小顺序为:c(Na+)>c(CHCOO-)>c(H+)=c(OH-) | |
| B. | 0.1mol/LKHS的溶液中,c(K+)═2c(S2-)+c(HS-)+c(H2S) | |
| C. | 25℃时,pH均为12的NaOH溶液和Na2CO3溶液中由水电离出的c(OH-),前者小于后者 | |
| D. | 中和pH和体积相同的盐酸与醋酸溶液,消耗NaOH的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 编号 | 1 | 2 | 3 | 4 |
| Na2S2O3溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 20.01 | 20.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; 、
、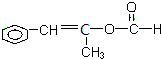 、
、 ;
; +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +NaCl+2H2O.
+NaCl+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅笔芯的原材料为铅,儿童使用铅笔时如果用嘴吮咬能够引起铅中毒 | |
| B. | 酸雨形成的主要原因是汽车尾气的任意排放 | |
| C. | 维生素C受热更易被氧化,故有些新鲜蔬菜生吃较好 | |
| D. | 淀粉、纤维素,、蛋白质和油脂均属于天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | ||
| Z |
| A. | 与X在同一周期的另一元素原子只有一种核素 | |
| B. | Y是一种很活泼的金属元素 | |
| C. | Z在空气中燃烧可生成最高价氧化物 | |
| D. | Z的最高价氧化物对应的水化物是一种强酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com