
下列粒子半径之比小于1的是( )。
| A.r (Na+)/ r (Na) | B.r (Cl-)/ r (Cl) | C.r (Na)/ r (Mg) | D.r (Ca)/ r (Mg) |
A
解析试题分析:原子失去电子变为阳离子,原子获得电子变为阴离子。A.对于同种元素的原子和阳离子来说,由于原子失去电子后变成的阳离子比原子少一个电子层,所以半径阳离子<原子。因此r (Na+)/ r (Na)< 1.正确。B.阴离子是原子获得电子后变成的。电子层数不变,但是由于正电荷没变,而负电荷数增大,所以核对电子的吸引力减小,阴离子的半径大于其相应的原子半径。r (Cl-)/ r (Cl) >1.错误。C.对于题意周期的元素来说,随着原子序数的增大,原子半径逐渐减小,所以r (Na)>r (Mg),r (Na)/ r (Mg) >1.错误。D.Mg、Ca是同一主族的元素,从上到下,元素的原子核外电子层数逐渐增多,原子半径逐渐增大。所以r (Ca)/ r (Mg) >1.错误。
考点:考查微粒半径的大小比较的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
下列有关化学用语使用正确的是( )
A.硫原子的原子结构示意图: |
B.NH4Cl的电子式: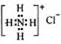 |
C.原子核内有10个中子的氧原子: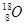 |
| D.纯碱的化学式为NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于元素周期表的说法正确的是
| A.能生成碱的金属元素都在ⅠA族 |
| B.原子序数为14的元素位于元素周期表的第3周期ⅣA族 |
| C.稀有气体元素原子的最外层电子数均为8 |
| D.第二周期ⅣA族元素的原子核电荷数和中子数一定为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
依据元素周期表及元素周期律,下列推断正确的是
| A.同周期主族元素的原子形成的简单离子电子层结构相同 |
| B.C比Si的原子半径小,CH4的稳定性比SiH4弱 |
| C.Na、Mg、Al失电子能力和其最高价氧化物对应的水化物的碱性均依次减弱 |
| D.在元素周期表金属与非金属的分界处可以寻找催化剂和耐高温、耐腐蚀的合金材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
甲、乙两种非金属性质比较:
①甲的单质熔、沸点比乙的低;
②甲单质能氧化乙原子的阴离子;
③最高价氧化物对应的水化物酸性比较,甲比乙的强;
④与金属反应时甲原子得电子的数目比乙多;
⑤甲单质比乙单质容易与氢气化合。
上述项目中能够说明甲比乙的非金属性强的是
| A.①②⑤ | B.③④⑤ | C.②③⑤ | D.②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知X为第三周期元素的原子,该原子要达到8电子稳定结构,则需要的电子数小于其次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是( )
| A.X元素最高价氧化物对应的水化物一定是强酸 |
| B.X元素的氢化物的化学式一定为H2X |
| C.X的单质一定是良好的半导体材料 |
| D.X元素的氧化物一定能与烧碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )。
| A.Li是最活泼金属,F是最活泼非金属 |
| B.Mg(OH)2碱性比Ca(OH)2强 |
| C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 |
D.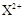 的核外电子数目为18,则X在第四周期第ⅡA族 的核外电子数目为18,则X在第四周期第ⅡA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
(双选)下列关于卤素的叙述正确的是( )。
| A.卤素只以化合态存在于自然界中 |
| B.随核电荷数增加,单质熔、沸点升高 |
| C.随核电荷数增加,单质氧化性增强 |
| D.单质与水反应,均可用通式X2+H2O=HX+HXO表示 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com