
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3moL•L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. | |
| 步骤2: | |
| 步骤3: |
分析 (1)氢氧化钠过量,二氧化硫和氢氧化钠反应生成亚硫酸钠和水;
(2)利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理,其中Cl2只作氧化剂的氧化还原反应生成硫酸钠、氯化钠和水;
(3)①根据反应原理:Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O,可假设1、溶液中可能存在只存在SO32-,2、既不存在SO32-也不存在ClO-,3、SO32-、ClO-都存在;
②根据所限制实验试剂和SO32-、ClO-的性质,先加入硫酸至酸性,若存在SO32-、ClO-,分别生成了H2SO3和HClO;因为HClO具有酸性和漂白性,选择紫色石蕊试液,证明有ClO-的存在;
H2SO3具有还原性,选择具有强氧化性高锰酸钾溶液,证明SO32-的存在.
解答 解:(1)SO2与过量NaOH溶液反应,因NaOH过量,故生成的是正盐,化学方程式为:SO2+2NaOH=Na2SO3+H2O;
故答案为:Na2SO3;
(2)利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理,其中Cl2只作氧化剂的氧化还原反应的离子方程式为:Cl2+SO32-+2OH-═2Cl-+SO42-+H2O,
故答案为:Cl2+SO32-+2OH-═2Cl-+SO42-+H2O;
(3)①根据反应原理:Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O,可提出以下假设:
假设1、溶液中可能存在只存在SO32,
假设2、既不存在SO32-也不存在ClO-,
假设3、SO32-和ClO-不能共存,所以另一种假设判断为只有ClO-;
故答案为:只有ClO-;
②因为吸收液呈碱性,先取少量吸收液于试管中,滴加3moL-L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中先加入硫酸的试管,若存在SO32-、ClO-,分别生成了H2SO3和HClO;
在A试管中滴加紫色石蕊试液,若先变红后褪色,证明有ClO-,否则无;
在B试管中滴加0.01mol•L-1KMnO4溶液,若紫红色褪去,证明有SO32-,否则无.
故答案为:
| 实验步骤 | 预期现象和结论 |
| 步骤2:在A试管中滴加紫色石蕊试液 | 若先变红后褪色,证明有ClO-,否则无 |
| 步骤3:在B试管中滴加0.01mol•L-1KMnO4溶液 | 若紫红色褪去,证明有SO32-,否则无 |
点评 本题属于实验探究题,要根据实验原理提出假设,再利用物质的性质加以验证,如利用次氯酸的酸性和漂白性验证是否含有次氯酸根离子,利用亚硫酸的还原性验证是否含有亚硫酸根离子,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.012 kg 12C中含有约 6.02×1023 个碳原子 | |
| B. | 1 mol H2O中含有2 mol氢和1 mol氧 | |
| C. | 氢氧化钠的摩尔质量等于它的相对分子质量 | |
| D. | 2 mol水的摩尔质量是1 mol水的摩尔质量的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
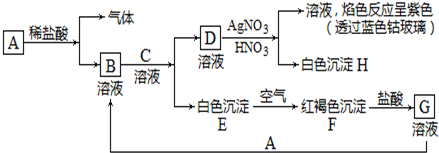
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
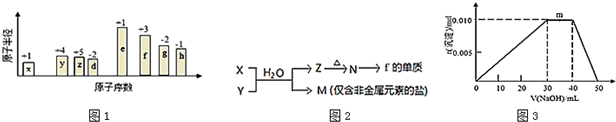
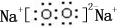 ;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)
;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
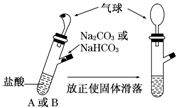 有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2 CO3 和0.84g NaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中下列叙述正确的是( )
有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2 CO3 和0.84g NaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中下列叙述正确的是( )| A. | A装置的气球膨胀速率大 | |
| B. | 若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol/L | |
| C. | 若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol/L | |
| D. | 最终两试管中Na +、Cl - 的物质的量一定相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com