
分析 (1)稀硫酸具有酸性和金属反应生成氢气;
(2)浓硫酸具有吸水性,可以干燥气体;
(3)浓硫酸具有脱水性,蔗糖中氢和氧原子按照2:1脱去发生炭化现象;
(4)乙醇和冰醋酸在浓硫酸做催化剂、吸水剂条件下生成乙酸乙酯;
(5)酯在稀硫酸催化剂作用下水解生成酸和醇,稀硫酸的催化剂作用;
(6)浓硫酸具有催化剂作用,纤维素在浓硫酸作用下水解生成葡萄糖;
(7)浓硫酸和铜在加热条件下反应,体现浓硫酸的酸性和强氧化性;
(8)浓硫酸使润湿蓝色石蕊试纸先变红后又变黑,体现浓硫酸的酸性和脱水性.
解答 解:(1)锌和稀H2SO4制H2利用的是稀硫酸的酸性,故答案为:①;
(2)浓硫酸具有吸水性,能吸收气体中的水蒸气可用作气体干燥剂,故答案为:②;
(3)浓硫酸与蔗糖的炭化实验体现了浓硫酸具有脱水性,蔗糖中氢和氧原子按照2:1脱去发生炭化现象,故答案为:②③④;
(4)乙醇和冰醋酸在浓硫酸做催化剂、吸水剂条件下生成乙酸乙酯,体现浓硫酸的催化作用、吸水性,故答案为:②⑤;
(5)乙酸乙酯的水解,在稀硫酸催化剂作用下水解生成酸和醇,稀硫酸的催化剂作用,故答案为:⑤;
(6)纤维素在浓硫酸作用下水解生成葡萄糖,体现了浓硫酸的催化作用,故答案为:⑤;
(7)浓硫酸和铜在加热条件下反应,生成二氧化硫和硫酸铜、水,既表现了浓硫酸的强氧化性又表现了酸性,故答案为:①④;
(8)浓硫酸具有酸性,所以能使湿润的蓝色石蕊试纸变红色,浓硫酸能将纸张中H、O元素以2:1水的形式脱去而体现脱水性,故答案为:①③.
点评 本题考查了稀硫酸、浓硫酸的性质,稀硫酸和浓硫酸具有酸性,浓硫酸还有特殊性吸水性、脱水性和强氧化性,注意吸水性和脱水性的区别,题目难度不大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:多选题
| A. | 上述氧化物都是酸性氧化物 | |
| B. | 该反应中NOx用作氧化剂,发生还原反应 | |
| C. | 当x=2时,每生成1molN2,转移电子数为4mol | |
| D. | 氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
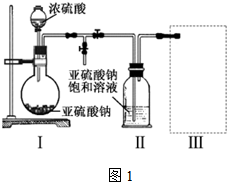
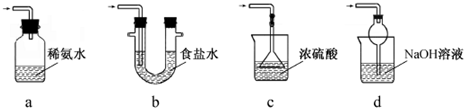

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:3 | C. | 3:2:1 | D. | 6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com