
(10分)短周期元素A、B、C、D、E原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与其气态氢化物乙反应可生成盐丙;D与A位于同一主族;在同周期元素形成的简单离子中,E的离子半径最小。
(1)实验室中可用A2C2制取C单质,其化学方程式是
(2)由A、C、D三种元素组成的化合物的电子式是 ;B、C、E三种元素组成的常见盐的水溶液呈酸性,原因是 (用离子方程式表示)。
(3)反应乙+C2→B2+A2C(未配平)可设计为燃料电池,则通入乙的电极是 (填“正”或“负”)极,在碱性条件下其电极反应是
(1)2H2O2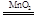 2H2O+O2↑;(2)
2H2O+O2↑;(2)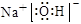 ; NH4+ + H2O
; NH4+ + H2O  NH3·H2O + H+;
NH3·H2O + H+;
(3)负极, 2NH3+6OH-—6e- N2+6H2O。
N2+6H2O。
解析试题分析:根据题意知,短周期元素A、B、C、D、E原子序数依次增大,A与C可形成A2C2和A2C两种化合物,实验室中可用A2C2制取C单质,则A为氢元素,C为氧元素,A2C2为H2O2,A2C为H2O;B的最高价氧化物对应的水化物甲与其气态氢化物乙反应可生成盐丙,则B为氮元素,甲为硝酸,乙为氨气,丙为硝酸铵;D与A位于同一主族,则D为钠元素;在同周期元素形成的简单离子中,E的离子半径最小,则E为铝元素。(1)实验室中可用H2O2制取O2,其化学方程式是2H2O2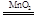 2H2O+O2↑;(2)由A、C、D三种元素组成的化合物氢氧化钠的电子式是
2H2O+O2↑;(2)由A、C、D三种元素组成的化合物氢氧化钠的电子式是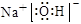 ;B、C、E三种元素组成的常见盐硝酸铵的水溶液呈酸性,原因是NH4+ + H2O
;B、C、E三种元素组成的常见盐硝酸铵的水溶液呈酸性,原因是NH4+ + H2O  NH3·H2O + H+;(3)反应NH3+O2→N2+H2O(未配平)可设计为燃料电池,氨气发生氧化反应,则通入氨气的电极是负极,在碱性条件下其电极反应是2NH3+6OH-—6e-
NH3·H2O + H+;(3)反应NH3+O2→N2+H2O(未配平)可设计为燃料电池,氨气发生氧化反应,则通入氨气的电极是负极,在碱性条件下其电极反应是2NH3+6OH-—6e- N2+6H2O。
N2+6H2O。
考点:考查元素推断及相关物质的性质。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:问答题
试利用平衡移动原理解释下列事实:
(1)FeS不溶于水,但能溶于稀盐酸中;
(2)CaCO3难溶于稀硫酸,却能溶于醋酸中;
(3)分别用等体积的蒸馏水和0.010 mol·L-1硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤的损失量。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(共15分)
某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成如下实验:
另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图_______ ,
写出气体甲的电子式________ 。
(2)X的化学式是____ ,在惰性气流中加热X至完全分解的化学方程式为_______________ 。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是________________ 。
(用化学方程式表示)。
(4)一定条件下,气体甲与固体1中某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式____________________________________________________________,
并设计实验方案验证该反应的产物_________________________________________
。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
X、Y、Z三种元素,原子序数依次减小。X是第四周期主族元素,其部分电离能如图所示;X、Y元素具有相同的最高正化合价;Z原子价电子排布式nsnnpn。回答下列问题:
(1)X原子的电子排布式为 。
(2)电负性:X Y(填“>”、“=”或“<”)。
(3)元素Z的一种氢化物(化学式为Z2H4)是重要的化工原料。 有关Z2H4分子的说法正确的是 (填字母)。
A.分子中含有氢键
B.属于非极性分子
C.含有4个σ键和1个π键
D.Z原子的杂化方式为sp2
(4)X的氧化物与钛(Ti)的氧化物相互作用,能形成钛酸盐,其晶体结构如图所示(X、Ti和O三种元素对应的离子分别位于立方体的体心、顶点和面心)。该晶体中,钛离子和周围 (填数字)个氧离子相紧邻。
(5)NH4Cl晶体中含有多种化学键,其中一定不含有的化学键是 (填字母)。
A.离子键 B.非极性键 C.配位键 D.金属键
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
短周期元素在元素中占有重要地位。X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:

一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。请回答下列问题:
(1)X元素在周期表中的位置是________周期____________族 。
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在_____________ 。
(3)在C分子中,Y原子的杂化方式为 ,与Y原子同主族在第四周期的元素原子基态电子排布式是 。
(4)NaCl的晶体结构如右上图所示,若将晶胞面心和体心的原子除去,顶点的钠离子换为Xn+(X代表某元素符号)离子,棱上的Cl-换为O2-,就得到X的氧化物的晶体结构。则该X的氧化物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(14分)锌锰废电池可用于生产硫酸锌及碳酸锰,其工艺流程分为预处理、硫酸锌生产线、碳酸锰生产线三部分。其中生产碳酸锰的工艺流程如下:
请回答下列问题:
(1)锌锰废电池的回收工艺中,从循环生产角度考虑,上述氢气的来源可以是________。
(2)原料锰粉粗品的主要成分为MnO2和碳,焙烧时一部分MnO2被还原,另一部
分被碳还原,MnO2被还原为一氧化锰。已知:
写出C(s)被MnO2(s)氧化为CO(g)的热化学方程式:________。
(3)50-55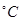 时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4+
时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4+
(4)已知三种离子沉淀时的pH范围:Fe3+:2.7~3.7,Mn2+:8.6~10.1,Fe2+:7.6~9.6。步骤②中除去的方法是先在酸性条件下加入_________,将Fe2+氧化为Fe3+,然后再将pH调至_______,使Fe3+沉淀完全。
(5)产品MnCO3溶于硫酸得硫酸锰溶液,电解该溶液可得二氧化锰,写出阳极的电极反应式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(16分)塑化剂又称增塑剂,是一种增加材料的柔软性或使材料液化的添加剂,不能用于食品、酒类等行业。
DEHP(C24H38O4)是增塑剂的一种,可通过下列流程制备,其中A的主链上有6个碳原子,D是对二甲苯的一种同分异构体,E的苯环上存在2种不同化学环境的氢原子。

(1)3—甲基庚烷的某同分异构体分子中只存在1种不同化学环境的氢原子,用系统命名法命名为 。
(2)写出B →C的化学反应方程式,请注明反应条件和反应类型。
B →C: ;反应类型: ;
(3)E的结构简式是 ;DEHP的结构简式是 ;
(4)F是E的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物; b.遇FeCl3溶液呈紫色; c.能与碳酸氢钠溶液反应。
写出F分子中官能团的名称为_________________________;
(5)G与E形成的混和物,只要物质的量一定,不论二者比例如何,燃烧耗氧是一定值。则满足条件的相对分子质量最小的G的分子式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(15分)化合物莫沙朵林(F)是一种镇痛药,它的合成路线如下(其中的THF是有关反应的催化剂):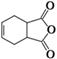
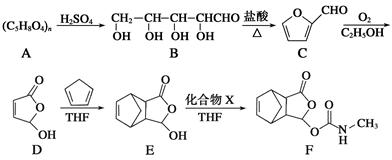
(1)化合物C中的含氧官能团的名称为 、 。化合物E的分子中含有的手性碳原子数为 。1 mol F最多可与 mol NaOH反应。
(2)化合物C与新制氢氧化铜的悬浊液反应的化学方程式为 。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式: 。
Ⅰ.分子的核磁共振氢谱图(1H核磁共振谱图)中有4个峰;Ⅱ.能发生银镜反应和水解反应;Ⅲ.能与FeCl3溶液发生显色反应,且与溴水反应。
(4)已知E+X→F为加成反应,则化合物X的结构简式为 。
(5)已知: 化合物G(结构如右下图所示)是合成抗病毒药阿昔洛韦的中间体。请写出以OHCCH(Br)CH2CHO
化合物G(结构如右下图所示)是合成抗病毒药阿昔洛韦的中间体。请写出以OHCCH(Br)CH2CHO
和1,3—丁二烯为原料制备G的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下: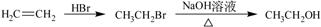
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com