
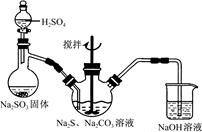



科目:高中化学 来源:不详 题型:实验题
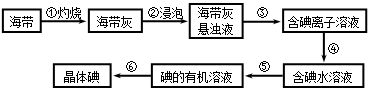
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.FeCl3溶液 | B.H2S | C.稀硫酸 | D.NaHCO3溶液 |
| T/℃ | 活性氧百分含量 | 产率 |
| 5~10 | 13.94 | 85.49 |
| 10~15 | 14.02 | 85.78 |
| 15~20 | 15.05 | 88.38 |
| 20~25 | 14.46 | 83.01 |
 、
、查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向卤代烃加硝酸酸化的硝酸银来检验其中的卤族素元素 |
| B.实验用NH4Cl固体受热分解来制备NH3 |
| C.用盐酸和澄清石灰水来检验某物质是否含有CO32- |
| D.可用下图所示的装置和药品来研究反应物浓度对反应速率的影响 |
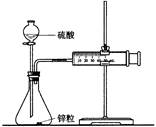
查看答案和解析>>
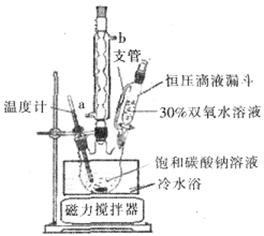
科目:高中化学 来源:不详 题型:实验题
 N2O3(g),其平衡常数表达式为K = 。
N2O3(g),其平衡常数表达式为K = 。查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| | |
| | 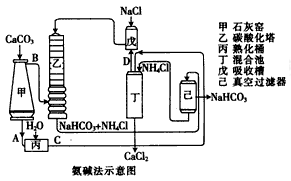 |
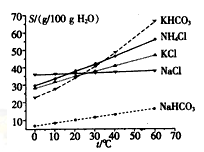
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

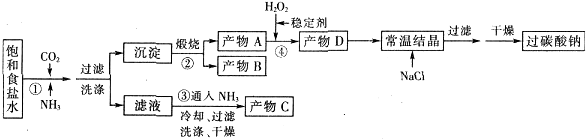
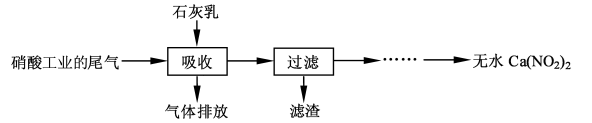
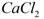 ,某化工厂设计了以下工艺流程:
,某化工厂设计了以下工艺流程: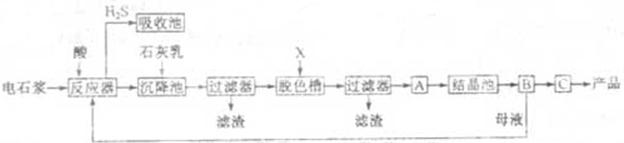
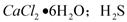 是一种酸性气体,且具有还原性。
是一种酸性气体,且具有还原性。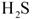 通入吸收池,下列物质中最适合作为吸收剂的是 ⑥ 。
通入吸收池,下列物质中最适合作为吸收剂的是 ⑥ 。| A.水 | B.浓硫酸 | C.石灰乳 | D.硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
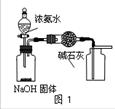
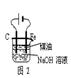
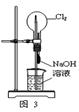
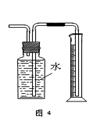
| A.用图1装置制取干燥纯净的NH3 |
| B.用图2装置实验室制备Fe(OH)2 |
| C.用图3装置可以完成“喷泉”实验 |
| D.用图4装置测量Cu与浓硝酸反应产生气体的体积 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| CuSO4 | 14.3 | 20.7 | 28.5 | 40.0 | 55.0 | 75.4 |
| Cu(NO3)2 | 81.8 | 124.8 | 163.1 | 181.8 | 207.8 | 247.3 |
| 实验步骤 | 预期现象 |
| 步骤1:除铁。将铜粉置于烧杯中,__________________ | _______________________ |
| 步骤2:溶解。将步骤1得到的铜粉置于烧杯中, __________________________ | _______________________ |
| 步骤3:结晶。将步骤2所得溶液蒸发浓缩至液面有晶膜出现,冷却至室温,过滤得粗产品 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com