
| 物质 | 除杂试剂 | 分离方法 | |
| A | 硫酸亚铁溶液(硫酸铜) | 铁粉 | 结晶 |
| B | BaSO4(BaCO3) | 盐酸 | 过滤 |
| C | NaCl溶液(I2) | 乙醇 | 分液 |
| D | 铁粉(铜粉) | 硫酸 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 有单质生成的反应一定是氧化还原反应 | |
| B. | 分解反应和复分解反应都不是氧化还原反应 | |
| C. | 氧化还原反应中一定有电子发生转移 | |
| D. | 置换反应也有可能是非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
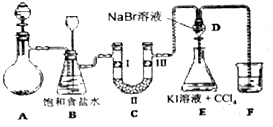
| 选项 | Ⅰ | Ⅱ | Ⅲ |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 硅胶 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该原子的摩尔质量是aNA | |
| B. | Wg该原子的物质的量一定是$\frac{W}{a{N}_{A}}$mol | |
| C. | Wg该原子中含有$\frac{W}{a}$个该原子 | |
| D. | 由已知信息可得:NA=$\frac{12}{b}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液.如图是医院病人输液使用的一瓶质量分数为6%的葡萄糖(C6H12O6相对分子质量为180)注射液标签,
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液.如图是医院病人输液使用的一瓶质量分数为6%的葡萄糖(C6H12O6相对分子质量为180)注射液标签,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对分子质量 M=$\frac{22.4mw}{[(1-w)V]}$ | B. | 物质的量浓度 c=$\frac{1000dV}{(MV+22.4m)}$ | ||
| C. | 溶质的质量分数 w=$\frac{MV}{22.4m}$ | D. | 溶液密度 d=$\frac{cM}{1000w}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 | |
| B. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 一氧化碳气体和氮气,若体积相等,则质量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质水解反应:HCO3-+H2O?H3O++CO32- | |
| B. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 微粒浓度关系:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 微粒浓度关系:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com