
| A. | 溶液中水电离出的c(OH-)=1×10-10 mol•L-1 | |
| B. | 溶液中的c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 溶液中的c(H+)+c(NH4+)=c(Cl-)+c(OH-) | |
| D. | 溶液中的c(NH3•H2O)=c(NH4+) |
分析 某浓度的氯化铵溶液的pH=4,说明溶液呈酸性,则c(H+)=1×10-4 mol•L-1、c(H+)>c(OH-),溶液中存在电荷守恒,结合电荷守恒来分析解答.
解答 解:A.pH=4的氯化铵溶液中:c(H+)=1×10-4 mol•L-1,铵根离子水解促进了水的电离,则水电离的氢离子浓度为1×10-4 mol•L-1,故A错误;
B.溶液呈酸性,则c(H+)>c(OH-),溶液中都存在电荷守恒c(H+)+c(NH4+)=c(Cl-)+c(OH-),则c(NH4+)<c(Cl-),盐溶液中c(Cl-)>c(H+),则离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),故B正确;
C.溶液中存在电荷守恒,根据电荷守恒得:c(H+)+c(NH4+)=c(Cl-)+c(OH-),故C正确;
D.铵根离子易水解而使溶液呈酸性,但水解程度较小,则c(NH3•H2O)<c(NH4+),故D错误;
故选AD.
点评 本题考查离子浓度大小比较,题目难度中等,溶液中铵根离子易水解而使溶液呈酸性,结合物料守恒及电荷守恒来分析解答,注意含有弱根离子的盐促进水电离.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸亚铁溶液中通入氯气 Fe2++Cl2═Fe3++Cl- | |
| B. | 碳酸镁跟稀硫酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ | |
| C. | 石灰乳与稀盐酸反应OH-+H+═2H2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
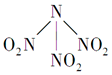 科学家最近研制出有望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
科学家最近研制出有望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )| A. | 分子中N、O间形成的共价键是非极性键 | |
| B. | 分子中4个氮原子共平面 | |
| C. | 该分子中的中心氮原子还有一对孤电子对 | |
| D. | 15.2 g该物质含有6.02×1022个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作氧化剂 | |
| B. | CuH在氯气中燃烧的化学反应方程式为2CuH+3Cl2 $\frac{\underline{\;点燃\;}}{\;}$2CuCl2+2HCl | |
| C. | CuH溶解在稀盐酸中生成的气体是氯气 | |
| D. | 如果选项C反应中生成了标准状况下22.4 L的气体,则转移电子3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在其他条件不变时,增加压强,N2的体积分数不变 | |
| B. | 前5 s内,用CO表示的反应速率等于0.1 mol•L-1•s-1 | |
| C. | 10 s时密闭容器中压强维持不变 | |
| D. | 保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将塑料废弃物加工成防水材料或汽油,变废为宝 | |
| B. | 煤燃烧产生的烟气直接排放到空气中,易造成水体的富营养化 | |
| C. | 食品添加剂必须用天然物质制造 | |
| D. | 乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com