
(2)近年来医学界发现,铝对人体健康危害性很大,能引起痴呆、骨痛、贫血、甲状腺功能降低、胃液分泌减少等多种疾病。为了防止铝对人体的慢性中毒,不要用铝锅来烹调酸、碱性强的食品,原因是____________。
解析:(1)H2SO3的酸性比H2CO3强,用Na2CO3吸收SO2,题目已指出产物是NaHSO3,不要误写为Na2SO3;题目已要求写离子方程式,不要写化学方程式。
Cl2具有强氧化性,可将![]() 氧化为
氧化为![]() ,为
,为![]() 提供氧原子的是水。
提供氧原子的是水。
(2)铝锅表面是一层致密的氧化物保护膜——Al2O3。Al和Al2O3都是既能与强酸反应,又能与强碱反应,这里主要是Al2O3与强酸或强碱的反应。
答案:(1)2SO2+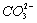 +H2O══2
+H2O══2![]() +CO2↑ 强
+CO2↑ 强 ![]() +Cl2+H2O══
+Cl2+H2O══![]() +2Cl-+2H+
+2Cl-+2H+
(2)铝和氧化铝都能跟酸、碱作用生成能被人体吸收的可溶性铝盐和偏铝酸盐:2Al+6H+══2Al3++3H2↑,2Al+2OH-+2H2O══2![]() +3H2↑,Al2O3+6H+══2Al3++3H2O,Al2O3+2OH-══2
+3H2↑,Al2O3+6H+══2Al3++3H2O,Al2O3+2OH-══2![]() +H2O。
+H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 时间(min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 10 | 7 | 5 | 3.5 | 2 | 1 | 1 | 1 |
| O2 | 5 | 3.5 | 2.5 | 1.75 | 1 | 0.5 | 0.5 | 0.5 |
| SO3 | 0 | 3 | 5 | 6.5 | 8 | 9 | 9 | 9 |
| 压强/MPa 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
查看答案和解析>>
科目:高中化学 来源:学习高手必修一化学人教版 人教版 题型:043
(1)为了保护环境,变害为利,工业上常用纯碱吸收有害气体SO2,同时得到亚硫酸氢钠,该反应的离子方程式是________.从这一反应可见H2SO3的酸性比H2CO3的酸性________.亚硫酸钠常用于除去漂白织物后剩余的游离氯,该反应的离子方程式为________.
(2)近年来医学界发现,铝对人体健康危害性很大,能引起痴呆、骨痛、贫血、甲状腺功能降低、胃液分泌减少等多种疾病.为了防止铝对人体的慢性中毒,不要用铝锅来烹调酸、碱性强的食品,原因是____________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com