
【题目】已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2bkJ/mol
B.C2H2(g)+![]() O2(g)═2CO2(g)+H2O(l)△H=2bkJ/mol
O2(g)═2CO2(g)+H2O(l)△H=2bkJ/mol
C.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣4bkJ/mol
D.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=bkJ/mol
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案科目:高中化学 来源: 题型:
【题目】化学是与社会、环境等密切相关。下列有关说法中正确的是
A.发展“低碳经济”能够减少对化石能源的依赖
B.人造纤维、合成橡胶和光导纤维都属于有机高分子化合物
C.LED光源中的氮化镓(GaN)熔点为1700℃,属分子晶体
D.甲型H1N1流感病毒的蛋白质由C、H、O三种元素组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H<0,下列叙述正确的是
4NO(g)+6H2O(g) △H<0,下列叙述正确的是
A.达到化学平衡时4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下反应最符合绿色化学原子经济要求的是( )
A. 乙烯聚合为聚乙烯高分子材料
B. 甲烷与氯气制备一氯甲烷
C. 以铁和浓HNO3为原料生产硝酸铁
D. 用碳来还原氧化铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种常用金属,镓(Ga)的化合物氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。
⑴Ga的原子结构示意图为 ___________________。
⑵GaN可由Ga和NH3在高温条件下制取,该反应的化学方程式 。
⑶下列有关镓和镓的化合物的说法正确的是____ 。
A.常温下,Ga可与水剧烈反应放出氢气
B.一定条件下,Ga可溶于盐酸和氢氧化钠
C.一定条件下,Ga2O3可与NaOH反应生成盐
D.Ga2O3可由Ga(OH)3受热分解得到
II.锌的冶炼方法有火法和湿法。工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示:
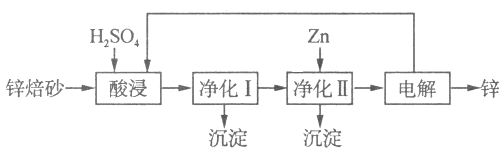
已知:Fe的活泼性强于Ni
⑷ZnFe2O4可以写成ZnO·Fe2O3,ZnFe2O4与H2SO4反应的化学方程式为 。
⑸净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____________________。
⑹净化II中加入Zn的目的是___________________。
⑺常温下,净化I中,如果要使c(Fe3+) < 10-5 mol/L,则应控制溶液pH的范围为_____________。已知:Ksp[Fe(OH)3] = 8.0 × 10-38;lg5 = 0.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌于一体的新型高效多功能水处理剂,干燥的高铁酸钾在198 ℃以下是稳定的,受热易分解。高铁酸钾在水处理过程中涉及的变化过程有( )
①蛋白质的变性 ②蛋白质的盐析 ③胶体聚沉 ④盐类水解 ⑤焰色反应 ⑥氧化还原反应
A.①②③④ B.①③④⑥
C.②③④⑤ D.②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国著名行业杂志《应用化学》上刊登文章介绍:某中德联合研究小组设计制造了一种“水瓶”,用富勒烯(C60)的球形笼子作“瓶体”,一种磷酸盐作“瓶盖”,恰好可将一个水分子关在里面。下列说法正确的是( )
A.水、双氧水、水玻璃都是纯净物
B.石墨和C60互称为同位素
C.磷酸钙是可溶性强电解质
D.一定条件下石墨转化为C60是化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备碱式碳酸铜的主要实验流程如下。

(1)滤渣Ⅰ的成分为MnO2、单质S和 (写化学式);硫酸浸取时,Cu2S被MnO2氧化的化学方程式为 。
(2)浸取时,Fe2O3溶于硫酸的离子方程式为 ;研究发现若先除铁再浸取,浸取速率明显变慢,其可能原因是 。
(3)“赶氨”时,最适宜的操作方法是 。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是 (写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是绿色氧化剂,且酸性介质下有更强的氧化性;易溶于水显弱酸性,常温下K1=1×10-12,K2=1×10-25。回答下列问题:
(1)常温下水的电离平衡常数K约为____________,K、K1、K2从大到小顺序为____________。
(2)在硫酸亚铁存在条件下,H2O2溶液可以把苯(C6H6)氧化为苯酚(C6H5OH)。反应后的混合物经过__________、蒸馏得到苯酚;理论上制取1mol苯酚需要消耗H2O2_______mol,实际消耗大于理论用量的主要原因是________________。
(3)K4[Fe(CN)6](黄色溶液)、K3[Fe(CN)6](黄绿色溶液)与一定量H2O2组成的混合物,用酸或碱调节混合溶液的pH,会出现黄色、黄绿色交替变化。按照从酸性至碱性的顺序,可观察到的现象是______________。
(4)工业用H2O2除去废水中的Cl2,氧化产物是__________;与SO2除Cl2相比,其优点是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com