
X、Y、Z、R、W是5种短周期元素,原子序数依次增大,它们可组成离子化合物Z2Y和共价化合物RY3、XW4,已知Y、R同主族,Z、R、W同周期。下列说法不正确的是( )
| A.原子半径:Z>R>W |
| B.XW4分子中各原子均满足8电子结构 |
| C.气态氢化物的稳定性:HmW>HnR |
| D.Y、Z形成的化合物中只可能存在离子键 |
D
解析试题分析:根据题意可知这几种元素分别是X:C;Y:O;Z:Na; R: S; W:Cl. A.Z、R、W是同一周期的元素。对于电子层数相同的元素来说,原子核外的电子数越多,原子半径越小。所以它们的原子半径大小顺序是:Z>R>W。正确。B.在CCl4中碳原子与四个Cl原子之间形成四对共用电子对,使每个原子都达到8电子的稳定结构。正确。C.氯和硫都是第三周期的元素,它们的非金属性Cl>S.元素的非金属性越强,其对应的氢化物就越稳定。所以稳定性HCl>H2S。正确。D.Na 和O两元素可以形成Na2O、 Na2O2两种氧化物。前者只有离子键。后者既有离子键也有非极性共价键。错误。
考点:考查元素的推断及形成的各种物质的结构和性质的知识。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:单选题
A、B、C、D都是短周期元素,原子半径:D > C > A > B。已知:A、B同周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的3倍,下列说法正确的是:
A.A的元素符号为Be
B.B和D两种元素形成的化合物中只能含有离子键
C.C和D两元素的最高价氧化物的水化物相互反应生成盐和水
D.D2B和D2B2阴、阳离子个数比分别为1:2和1:1
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中Z的一种氧化物能使品红溶液褪色,则下列说法正确的是( )
| A.非金属性:R<T<Q | B.T与Q的电子数相差18 |
| C.原子半径:R< T< Z | D.X的氧化物既能与盐酸反应又能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是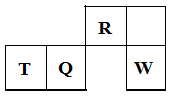
| A.最简单气态氢化物的热稳定性:R>Q |
| B.最高价氧化物对应水化物的酸性:Q<W |
| C.原子半径:T>Q>R |
| D.含T的盐溶液一定显示酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述不正确的是 ( )
| A.若周期表中第七周期完全排满共有32种元素 |
| B.周期表中共有18个列,其中形成化合物种类最多的在第14列 |
| C.在氯化钠和氯化铯晶胞中阳离子的配位数分别为8和6 |
| D.在二氧化碳晶胞中每个二氧化碳分子周围紧邻二氧化碳分子有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
据报道,美国夏威夷联合天文中心的科学家发现了一种新型氢粒子,这种粒子是由3个氢原子核(只有质子)和2个电子构成。对于这种粒子,下列说法中正确的是( )
| A.是氢的一种新的单质 | B.是氢的一种新的同位素 |
| C.它的组成可用H3表示 | D.它比一个普通H2分子多一个氢原子核 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知1~18号元素中,元素X、Y最外层分别有n个和(m-5)个电子,次外层分别有(n+2)和m个电子,据此可推断元素x和y能形成化合物的分子式为( )
| A.X3Y2 | B.X2Y3 | C.X2Y | D.XY2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中X所处的周期序数与族序数相等。下列说法错误的是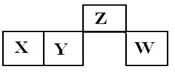
| A.Z的氧化物与W的氧化物的化学键类型相同 |
| B.X、Z的氧化物都能溶于氢氧化钠和稀硫酸溶液中 |
| C.最高价氧化物对应水化物稀溶液的氧化性:W<Z |
| D.Y原子的半径比W原子的半径大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com