
 苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为:
苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为: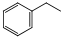 (g)$?_{高温(T)}^{Fe_{2}O_{3}}$
(g)$?_{高温(T)}^{Fe_{2}O_{3}}$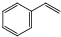 (g)+H2(g)△H=+120kJ•mol-1
(g)+H2(g)△H=+120kJ•mol-1分析 (1)升高反应温度,平衡向吸热反应方向移动,任何反应速率均增大;
(2)等温、等压下,通入惰性气体,体积膨胀,相当于减小反应体系的压强,平衡向气体体积缩小的方向移动;
(3)通入水蒸气,Fe2O3在H2氛围下可生成水蒸气,加入水蒸气可促使反应左移即向生成Fe2O3的方向移动;
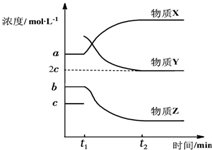
(4)①在t1时刻加入H2,根据图象物质X的浓度增加,则物质X为乙苯,因加入H2后平衡向左移动,故乙苯浓度增大;
②在t1时刻加入H2,则温度不变,t2时刻再次达到平衡与原平衡平衡常数相同,据此利用三段法计算;
③根据v=$\frac{△c}{△t}$计算;
(5)根据盖斯定律计算.
解答 解:(1)升高反应温度,平衡向吸热反应方向移动,该反应正向吸热,升高反应温度,平衡正向移动,乙苯转化率增大,升高反应温度任何反应速率均增大,
故答案为:增大;增大;
(2)等温、等压下,通入惰性气体,体积膨胀,相当于减小反应体系的压强,平衡向气体体积缩小的方向即正向移动,提高反应的转化率,
故答案为:体积变大,反应向分子数增加的方向进行;
(3)通入水蒸气,Fe2O3在H2氛围下可生成水蒸气,加入水蒸气可促使反应左移即向生成Fe2O3的方向移动,
故答案为:Fe2O3 在 H2 氛围下可生成水蒸气,加入水蒸气可促使反应左移;
(4)①在t1时刻加入H2,根据图象物质X的浓度增加,则物质X为乙苯,因加入H2后平衡向左移动,故乙苯浓度增大,
故答案为:乙苯;加入H2后平衡向左移动,故乙苯浓度增大;
②根据图象t1时刻平衡时c(乙苯)=amol•L-1,c(苯乙烯)=bmol•L-1,
c(氢气)=cmol•L-1,则该温度下K=$\frac{bc}{a}$;
设t1时刻加入xmol•L-1H2,则根据图象t2时刻再次达到平衡c(氢气)=2cmol•L-1,则
 (g)$?_{高温(T)}^{Fe_{2}O_{3}}$
(g)$?_{高温(T)}^{Fe_{2}O_{3}}$ (g)+H2(g)
(g)+H2(g)
t1(mol•L-1) a b c+x
转化浓度(mol•L-1) x-c x-c c+x-2c=x-c
t2(mol•L-1) a+(x-c) b-(x-c) 2c
在t1时刻加入H2,则温度不变,t2时刻再次达到平衡与原平衡平衡常数相同,则K=$\frac{bc}{a}$=$\frac{(b-x+c)×2c}{a+x-c}$,则x=$\frac{2ac+bc+ab}{2a+b}$,则t2时刻,苯乙烯的浓度为b-(x-c)=$\frac{{b}^{2}+ab}{2a+b}$mol•L-1,
故答案为:$\frac{{b}^{2}+ab}{2a+b}$;
③由②分析t1-t2时间段内,乙苯转化浓度为x-c=$\frac{ab}{2a+b}$mol•L-1,则反应速率为v=$\frac{△c}{△t}$=$\frac{ab}{(2a+b){(t}_{2}-{t}_{1})}$mol•L-1,
故答案为:$\frac{ab}{(2a+b){(t}_{2}-{t}_{1})}$;
(5)根据盖斯定律乙苯的燃烧热△H=-290kJ•mol-1 +(-4400kJ•mol-1)+(+120kJ•mol-1)=-4570kJ•mol-1,
故答案为:-4570.
点评 本题主要考查外界条件对反应速率及平衡移动的影响,及根据图象计算化学反应速率和利用盖斯定律计算反应热,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| B. | 物质燃烧不一定是放热反应 | |
| C. | 放热的化学反应不需要加热就能发生 | |
| D. | 吸热反应不加热就不会发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ;B与D形成的化合物BD2的结构式是O=C=O,BD2属于共价(填“离子”或“共价”)化合物.
;B与D形成的化合物BD2的结构式是O=C=O,BD2属于共价(填“离子”或“共价”)化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
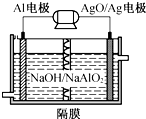 铝电池性能优越,Al-AgO电池可作为水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH═2NaAlO2+3Ag+H2O,则下列说法错误的是( )
铝电池性能优越,Al-AgO电池可作为水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH═2NaAlO2+3Ag+H2O,则下列说法错误的是( )| A. | OH-向Al电极移动 | |
| B. | 正极的电极反应式:O2+2H2O+4e-═4OH- | |
| C. | Al电极的电极反应式:Al-3e-+4OH-═AlO2-+2H2O | |
| D. | 当电极上析出0.54 g Ag时,电路中转移的电子为0.005 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com