
【题目】在体积可变的密闭容器中投入0.5mol CO和1mol H2,不同条件下发生反应:![]() 。实验测得平衡时H2的转化率随温度、压强的变化如图1所示。下列说法错误的是( )
。实验测得平衡时H2的转化率随温度、压强的变化如图1所示。下列说法错误的是( )

A.Y代表压强,且![]() ;X代表温度,且
;X代表温度,且![]()
B.M点反应物转化率之比![]() ,N点该比例减小
,N点该比例减小
C.若M、N两点对应的容器体积均为5L,则N点的平衡常数![]()
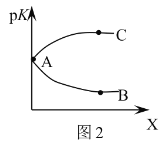
D.图2中曲线AB能正确表示该反应平衡常数的负对数![]() 与X的关系
与X的关系
【答案】BD
【解析】
A.若X为压强,Y为温度,由图可知相同温度下压强越大氢气的转化率越小,而该反应为气体体积减小的反应,相同温度下压强越大H2的转化率越大,所以Y为压强,X为温度,且![]() ;相同压强下温度越高,氢气的转化率越小,说明升高温度平衡逆向移动,正反应为放热反应,即
;相同压强下温度越高,氢气的转化率越小,说明升高温度平衡逆向移动,正反应为放热反应,即![]() ,故A正确;
,故A正确;
B.初始投料n(CO):n(H2)=1:2,根据方程式可知反应过程中CO和H2按照1:2反应,所以任意时刻二者的转化率之比均为1:1,故B错误;
C.N点和M点温度相同,则平衡常数相同,容器体积为5L,M点H2的转化已知,为50%,可根据该点列三段式

根据平衡常数的定义可知K=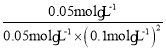 =
=![]() ,故C正确;
,故C正确;
D.![]() ,则K越大,pK越小,该反应正反应为放热反应,温度越高K越小,则pK越大,故曲线AC表示该反应平衡常数的负对数
,则K越大,pK越小,该反应正反应为放热反应,温度越高K越小,则pK越大,故曲线AC表示该反应平衡常数的负对数![]() 与X的关系,故D错误;
与X的关系,故D错误;
故答案为BD。


科目:高中化学 来源: 题型:
【题目】为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
已知:相关物质的溶解度(20℃)AgCl:1.5×10-4g Ag2SO4:0.796 g
(1)甲同学的实验如下:
序号 | 操作 | 现象 |
实验Ⅰ | 将2 mL 1 mol/L AgNO3溶液加入到1 mL 1 mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
取上层清液,滴加KSCN 溶液 | 溶液变红 |
注:经检验黑色固体为Ag
① 白色沉淀的化学式是_____________。
② 甲同学得出Ag+氧化了Fe2+的依据是_______________。
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ。
a.按右图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。偏移的方向表明:电子由石墨经导线流向银。放置一段时间后,指针偏移减小。
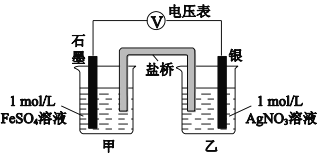
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
① a中甲烧杯里的电极反应式是___________。
② b中电压表指针逆向偏移后,银为_________极(填“正”或“负”)。
③ 由实验得出Ag+和Fe2+反应的离子方程式是___________。
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
序号 | 操作 | 现象 |
实验Ⅲ | 将2 mL 2 mol/L Fe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
实验Ⅳ | 将2 mL1 mol/L Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
实验Ⅴ | 将2 mL 2 mol/L FeCl3溶液加入有银镜的试管中 | 银镜消失 |
① 实验Ⅲ___________(填“能”或“不能”)证明Fe3+氧化了Ag,理由是_____________。
② 用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用氧化锌矿粉(主要含ZnO、FeCO3、CuO等)制备碱式碳酸锌[Zn2(OH)2CO3],并将其用于合成氨工艺脱硫研究。
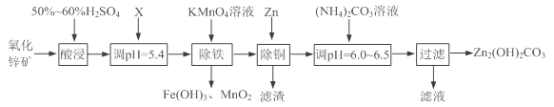
(1)“酸浸”时保持H2SO4过量的目的是___________。
(2)已知:Mn2+开始沉淀的pH=8.1。
①写出加入KMnO4溶液除铁的离子方程式:___________。
②流程中调节pH=5.4所加试剂X为____(填化学式);试剂X、KMnO4溶液加入顺序能否互换?请判断并说明理由_____。
(3)上述流程中滤渣的成分为___________(写化学式);“滤液”可以用作化肥,该滤液的主要成分为___________(填化学式)。
(4)检验Zn2(OH)2CO3是否洗涤干净的方法是___________。
(5)合成氨原料气脱硫原理如图,碱式碳酸锌吸收硫化氢的化学方程式为______。
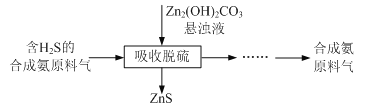
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
a | 原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
b | 基态原子的p轨道电子数比s轨道电子数少1 |
c | 位于第2周期,原子核外有3对成对电子、两个未成对电子 |
d | 位于周期表中第1纵列 |
e | 基态原子M层全充满,N层只有一个电子 |
请回答:
(1)c属于_____________区的元素。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为______________(用元素符号表示)。
(3)若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的中心原子的轨道杂化类型为_____________,A的空间构型为____________________;
(4)d 的某氯化物晶体结构如图,每个阴离子周围等距离且最近的阴离子数为________;在e2+离子的水溶液中逐滴滴加b的氢化物水溶液至过量,可观察到的现象为_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在105℃、1个大气压时,取两种气态烃1L与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L。有下列组合的混合烃:①C2H4和C3H4 ②CH4和C2H6 ③CH4和C3H4 ④C2H2和C3H6,其中可能符合上述要求的是
A. 只有①②B. 只有①③④C. 只有①③D. 只有②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业电解![]() 溶液的装置如图所示,A、B两极均为惰性电极。下列说法正确的是( )
溶液的装置如图所示,A、B两极均为惰性电极。下列说法正确的是( )
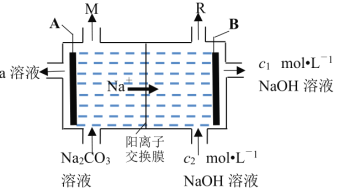
A.该装置可用于制备![]() 溶液,其中A极发生还原反应
溶液,其中A极发生还原反应
B.生成a溶液的电极室中反应为:![]()
C.A极还可能有少量CO2产生,A、B两极产生的气体M和R体积比略大于2:1
D.当![]() 时,则另一室理论上可制备4mol溶质a(假设右室溶液体积为0.5L)
时,则另一室理论上可制备4mol溶质a(假设右室溶液体积为0.5L)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示的装置制备乙酸乙酯,回答下列相关问题:
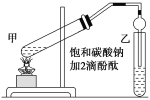
(1)连接好装置后,在加入试剂之前需要做的操作是________________________
(2)在甲试管(如图)中加入2 mL浓硫酸、3 mL乙醇和2 mL乙酸的混合溶液,加入上述试剂的顺序为_____________________________________________
(3)甲试管中需加入少量__________以防止暴沸
(4)浓硫酸在反应中的作用是_______________________
(5)甲试管中反应的化学方程式___________________________________________
(6)乙中导管没有深入到液面下,原因是_____________________
(7)上述实验中饱和碳酸钠溶液的作用是:______(填序号)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(8)欲将乙试管中的物质分离开得到乙酸乙酯,采取的实验方法是_______;分离时,乙酸乙酯应该从仪器的________(填“下口放出” 或“上口倒出”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成EPR橡胶(![]() )广泛应用于防水材料、电线电缆护套、耐热胶管等;PC塑料(
)广泛应用于防水材料、电线电缆护套、耐热胶管等;PC塑料(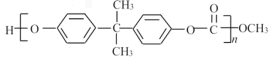 )透光性良好,可制作挡风玻璃以及眼镜等。它们的合成路线如下:
)透光性良好,可制作挡风玻璃以及眼镜等。它们的合成路线如下:
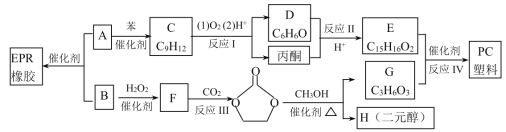
已知:①![]()
②(CH3)2C=CHCH3+H2O2![]()
![]() +H2O
+H2O
③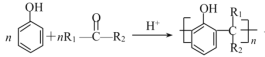 +nH2O
+nH2O
(1)A的名称为________,反应Ⅲ的反应类型为___________,H的结构简式为___________。
(2)在工业生产过程中,反应Ⅰ除了能得到高纯度的苯酚和丙酮之外,还能回收副产物![]() 和______________。
和______________。
(3)反应Ⅱ发生时,条件控制不当有可能生成高分子化合物,其结构简式可能是________。
(4)反应Ⅳ的化学方程式为_____________________________。
(5)有机物E满足下列条件的同分异构体有__________种。
①含2个苯环和2个羟基,且2个羟基不能连在同一个碳上
②与FeCl3溶液不能显紫色
③核磁共振氢谱显示有5组峰,峰面积比为1:2:2:2:1
(6)已知: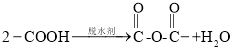 。以邻二甲苯和苯酚为原料合成酚酞(
。以邻二甲苯和苯酚为原料合成酚酞(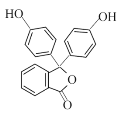 ),无机试剂任选,写出合成路线________________。(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
),无机试剂任选,写出合成路线________________。(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A的蒸汽对氢气的相对密度是15,且能发生银镜反应,F的分子式为C3H6O2。有关物质的转化关系如下:
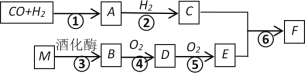
请回答:
(1)B中含有的官能团名称是__________,反应⑥的反应类型为__________。
(2)写出A发生银镜反应的化学方程式__________。
(3)写出反应④的化学方程式__________。
(4)写出有机物F与NaOH溶液反应的化学方程式__________。
(5)下列说法正确的是__________。
A 有机物D的水溶液常用于标本的防腐
B 有机物B、C、E都能与金属钠发生反应
C 有机物F中混有E,可用饱和碳酸钠溶液进行分离
D 有机物M为高分子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com